Muchos crustáceos decápodos con dimorfismo sexual en el tamaño del cuerpo son especies de importancia económica para la acuicultura, haciendo del cultivo monosexo una práctica deseable para incrementar las producciones y las ganancias.
El establecimiento de poblaciones monosexuales en el camarón gigante de agua dulce Macrobrachium rosenbergii, se ha intentado el mismo enfoque de manipulación en camarones peneidos, cangrejos y langostas de importancia comercial, sin éxito.
Hay muchos factores en juego con las complejidades específicas de la especie que requieren un examen minucioso al abordar la producción monosexual.
Un equipo de investigadores de la University of the Sunshine Coast publicaron una revisión científica que proporciona una hoja de ruta para la manipulación sexual exitosa en crustáceos decápodos, destacando los aspectos clave y las brechas críticas en el conocimiento.
Significado de la manipulación del sexo en decápodos
La manipulación sexual puede ser usada por diversas razones según la especie y la aplicación. Para la acuicultura, tiende a favorecerse el género que proporciona los animales más grandes.
Por ejemplo, las hembras de especies de peneidos crecen más rápido y más grandes; por lo tanto, se busca un enfoque para desarrollar poblaciones exclusivamente femeninas.
Diversas investigaciones proyectan que la aplicación exitosa del cambio de sexo conduce a un aumento significativo en los ingresos de los camaroneros.
En el caso del camarón gigante de agua dulce, las investigaciones han reportado que las poblaciones mixtas y exclusivamente femeninas crecen entre 1.5 y 2 veces más lentamente que las poblaciones exclusivamente masculinas logradas mediante clasificación manual.
En la actualidad, se ha desarrollado el cultivo de poblaciones monosexo de M. ronsebergii mediante la técnica patentada de silenciamiento del gen iag10 y marcadores genéticos de sexo esenciales para validar la manipulación sexual exitosa.
La manipulación sexual en decápodos es necesaria para lograr un mayor rendimiento, mayores ganancias o una mayor productividad acuícola.
Además de las aplicaciones en la industria acuícola, las poblaciones monosexuales de decápodos pueden ser empleados para el control de portadores de patógenos humanos; debido a que las poblaciones monosexuales no pueden reproducirse, se pueden usar de manera segura como agente de biocontrol en los países de África occidental para las infestaciones de esquistosomiasis y también para reducir el riesgo de invasión de especies exóticas invasoras.
Enfoque biotecnológico para el monosexo en decápodos
Si bien se demostró que el concepto de cultivo monosexual de crustáceos era factible mediante la segregación manual, no fue hasta que la investigación identificó marcadores genéticos de sexo y el iag que esto se convirtió en una realidad comercial, lo que indica que el desarrollo de un cultivo monosexo sostenible requiere el establecimiento de una biotecnología eficiente.
En M. rosenbergii, la producción monosexual es una práctica común hoy en día, debido al establecimiento de marcadores genéticos sexuales y al silenciamiento génico dirigido por iag; esto se realiza en la etapa temprana de desarrollo, antes del establecimiento de las características sexuales.
Los acuicultores que usan la tecnología patentada informan un aumento significativo en los ingresos debido a que los machos de M. rosenbergii crecen más y más rápido que las hembras.
Aspectos claves a considerar
Glándula androgénica
Se conoce que la glándula androgénica (AG) específica de los camarones de río machos media la masculinización al producir y secretar la hormona AG similar a la insulina (IAG).
Se ha informado que el patrón espacial de expresión de iag varía entre las especies de decápodos. En algunos decápodos, iag se expresa solo en el AG, mientras que en otras especies iag se expresa en múltiples tejidos.
Sin embargo, en M. rosenbergii, donde la manipulación de iag es exitosa, la expresión de iag se detectó exclusivamente en el AG. Esta observación podría explicar por qué la manipulación de AG condujo al cambio de sexo completo en M. rosenbergii y tal vez podría explicar por qué fracasó en otras especies.
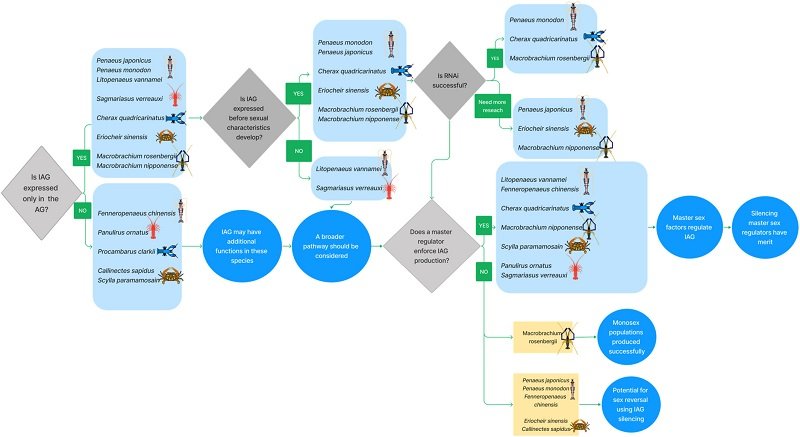
Dado que hasta la fecha no se logró un cambio de sexo exitoso en ninguna especie de decápodo que no sea M. rosenbergii, se deben considerar más aspectos, como se detalla a continuación.
¿Cuándo inicia la expresión de iag?
Está bien establecido que IAG regula el desarrollo de las características sexuales primarias y secundarias masculinas. Está claro, sin embargo, que IAG no es un factor determinante del sexo.
Cuando se silencia iag en estos individuos intersexuales, el ovario detenido madura y produce vitelogenina, mientras que la espermatogénesis retrocede, cambiando el equilibrio hacia un fenotipo femenino.
¿Es eficaz el silenciamiento génico por ARN de interferencia (RNAi)?
El uso de RNAi para la manipulación sexual en crustáceos decápodos es una aplicación muy práctica en la acuicultura. El silenciamiento in vivo mediante la inyección de camarones de agua dulce, M. rosenbergii, con dsRNA específico de Mr-iag, en una etapa temprana de desarrollo en machos jóvenes, indujo un cambio completo de sexo y funcional de machos genéticos en neo-hembras.
Además, en el camarón tigre, P. monodon, y el cangrejo de río australiano, C. quadricarinatus, la tecnología de ARNi se ha aplicado con éxito para la manipulación de genes. Sin embargo, en varias otras especies de decápodos, la tecnología de ARNi no funcionó de manera eficiente.
Otras vías de manipulación sexual
Otros medios de manipulación endocrina han atraído una atención considerable y han tenido cierto éxito en sesgar la proporción de sexos en los crustáceos. La proporción de sexos en juveniles de M. rosenbergii se alteró significativamente al alimentarlos con Artemia enriquecida con lípidos con 17a-metiltestosterona (MT).
Además se ha demostrado que la temperatura, la salinidad, la luz y otros factores afectan la determinación y diferenciación del sexo de algunos crustáceos. El shock frío induce triploidía y cambia la proporción de sexos en P. monodon, mientras que el fotoperíodo influye en la proporción de sexos en Gammarus deubeni.
Otro camino prometedor hacia la manipulación sexual exitosa incluye la edición del genoma en crustáceos. La primera edición del genoma en decápodos eliminó un gen regulador de la formación de ojos en el langostino oriental Exopalaemon carinicauda usando CRISPR/Cas9 microinyectado en embriones
Conclusión
“Proporcionamos aquí una hoja de ruta detallada para la manipulación sexual exitosa en crustáceos decápodos, destacando las advertencias clave a considerar y las lagunas críticas en el conocimiento actual”, destacan los investigadores.
Ellos recomiendan tener en cuenta el momento de la expresión de iag en relación con el desarrollo de caracteres sexuales, la relación entre IAG y un regulador sexual maestro, así como la capacidad de silenciamiento de genes.
“Hasta la fecha, se ha dilucidado una gran cantidad de genes que regulan el desarrollo sexual en no decápodos, facilitado en gran medida por las tecnologías de secuenciación de ADN y ARN de vanguardia y el análisis bioinformático”, concluyen.
El estudio fue financiado por la Australian Research Council y la University of the Sunshine Coast.
Contacto
Tomer Ventura
Centre for Bioinnovation
University of the Sunshine Coast,
Sippy Downs, Queensland, 4556, Australia.
Email: tventura@usc.edu.au
Referencia (acceso abierto)
Nguyen, AHT, Glendinning, S, Ventura, T. A refined roadmap to decapod sexual manipulation. Rev Aquac. 2023; 1- 10. doi:10.1111/raq.12808

