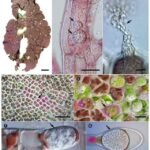
La Saprolegnia, comúnmente conocida como el «moho acuático» o causante de la «enfermedad del algodón», es un microorganismo que representa una amenaza significativa tanto para la industria de la acuicultura como para los aficionados a los peces ornamentales. Aunque a menudo se le denomina hongo, es importante destacar que Saprolegnia pertenece al grupo de los Oomicetos, organismos filamentosos distintos de los hongos verdaderos. Este patógeno oportunista puede afectar a una amplia gama de organismos acuáticos, incluyendo peces, anfibios (como los ajolotes) y, en menor medida, crustáceos, provocando la enfermedad conocida como Saprolegniasis.
En los peces de agua dulce, principalmente los peces ornamentales, y en los peces estuarinos (Vajargah y Majidiyan, 2022), los hongos del género Saprolegnia son causantes de la enfermedad conocida como Saprolegniasis o la «enfermedad de algodón». La presencia de la Saprolegniasis puede derivar en considerables pérdidas económicas en piscifactorías y una gran preocupación para los cuidadores de acuarios. Entre las enfermedades micóticas de peces de agua dulce la enfermedad de la Saprolegniasis es una de las enfermedades de mayor importancia económica (Lone y Manohar, 2018). Comprender sus causas, identificar sus síntomas a tiempo y conocer las estrategias de tratamiento y prevención es crucial para mantener la salud de las poblaciones acuáticas.
- 1 ¿Qué es Saprolegnia y cómo causa la Saprolegniasis?
- 2 Ciclo de vida de Saprolegnia: Un patógeno adaptable
- 3 Factores predisponentes y causas comunes de la Saprolegniasis
- 4 Síntomas y signos clínicos de la Saprolegniasis: Reconociendo la enfermedad del algodón
- 5 Diagnóstico de la Saprolegniasis: Confirmando la infección
- 6 Especies acuáticas afectadas por Saprolegnia: Un amplio rango de huéspedes
- 7 Tratamiento y control de la Saprolegniasis: Estrategias actualizadas
- 8 Prevención: La mejor estrategia contra la Saprolegnia
- 9 Impacto de la Saprolegniasis en la acuicultura
- 10 Conclusión
-
11
Preguntas Frecuentes (FAQ)
- 11.1 ¿La Saprolegnia puede afectar a los humanos?
- 11.2 ¿Cómo puedo diferenciar la Saprolegnia de otras manchas blancas en mis peces?
- 11.3 ¿Es seguro usar sal común para tratar la Saprolegnia en todos los peces?
- 11.4 ¿Qué tan rápido puede actuar la Saprolegnia?
- 11.5 ¿Puedo usar medicamentos para hongos humanos en mis peces?
- 12 Referencias bibliográficas
- 13 Entradas relacionadas:
¿Qué es Saprolegnia y cómo causa la Saprolegniasis?
El género Saprolegnia agrupa a oomicetos filamentosos que se encuentran de forma natural en la mayoría de los ecosistemas de agua dulce. Estos microorganismos actúan principalmente como saprofitos, descomponiendo materia orgánica muerta, pero bajo ciertas condiciones, se convierten en necrótrofos, capaces de infectar tejidos vivos de animales acuáticos debilitados o con lesiones previas. Las características de Saprolegnia sp. incluyen la formación de una masa algodonosa de micelio (conjunto de hifas) sobre el huésped.
Taxonomía de Saprolegnia
Reino: Chromista
Filo: Oomycota
Orden: Saprolegniales
Familia: Saprolegniaceae
Género: Saprolegnia
Especies: Saprolegnia aenigmatica, S. anisospora, S. anomalies, S. asterophora, S. australis, S. bulbosa, S. delica, S. diclina, S. eccentrica, S. ferax, S. cf. ferax, S. furcata, S. hypogyna, S. lapponica, S. litoralis, S. longicaulis, S. megasperma, S. milanezii, S. mixta, S. monilifera, S. monoica, S. multispora, S. oliviae, S. parasitica, S. polymorpha, S. racemosa, S. salmonis, S. semihypogyna, S. subterranea, S. terrestris, S. torulosa, S. truncata, S. turfosa, S. unispora
Mantente siempre informado
Únete a nuestras comunidades para recibir al instante las noticias, informes y análisis más importantes del sector acuícola.
Nombres comunes en español: moho de agua o moho de algodón
Nombres comunes en inglés: water mold o cotton mold.
Es importante destacar que Saprolegnia es un género que reúne a muchas especies de hongos que viven en el agua dulce o salobre, y pueden infectar a los peces, anfibios y crustáceos (Kumar et al, 2020). Entre las especies más relevantes se encuentran:
- Saprolegnia parasitica: Considerada la especie más virulenta y comúnmente aislada en infecciones de peces de agua dulce, tanto en acuicultura (especialmente salmónidos) como en peces ornamentales. De acuerdo con Kumar et al., (2020) S. parasitica es uno de los patógenos de peces más severos, responsables de grandes pérdidas en la industria acuícola en todo el mundo.
- Saprolegnia diclina: Frecuentemente asociada con infecciones en huevos de peces y también patógena para anfibios. Hendrik et al., (2013) reportó que S. diclina es un oomiceto que infecta los huevos de los animales acuáticos.
- Otras especies como Saprolegnia ferax y Saprolegnia australis también han sido identificadas en brotes de la enfermedad.
Mecanismo de infección de la Saprolegnia
El mecanismo de infección de la Saprolegniasis comienza cuando las zoosporas móviles de Saprolegnia (su forma infectiva) encuentran un huésped susceptible, generalmente a través de una herida en la piel, branquias dañadas o en peces con el sistema inmune comprometido. Diversos estudios han reportado que algunas especies como S. parasitica utilizan proteínas específicas para adherirse a los tejidos del huésped. Una vez adheridas, las zoosporas enquistan y germinan, desarrollando hifas que penetran los tejidos, liberando enzimas que causan daño y necrosis celular, lo que se manifiesta como las típicas lesiones algodonosas.
Trusch et al., (2018) proporciona un modelo detallado de cómo un oomiceto patógeno animal secreta una proteína efectora (SpHtp3) que se auto-transloca a las células del hospedador a través de un receptor gp96-like y es liberada en el citoplasma por otra proteína efectora (SpHtp1) para ejercer su función de nucleasa.
Ciclo de vida de Saprolegnia: Un patógeno adaptable
Comprender el ciclo de vida de Saprolegnia es fundamental para entender su persistencia y capacidad de infección. Este oomiceto presenta dos fases reproductivas principales:
- Reproducción Asexual: Es la forma más común de propagación y diseminación.
- Las hifas somáticas desarrollan estructuras alargadas llamadas zoosporangios.
- Dentro de los zoosporangios se forman numerosas zoosporas primarias, que son biflageladas (con dos flagelos que les permiten movilidad en el agua).
- Estas zoosporas son liberadas y nadan activamente en busca de un sustrato adecuado (materia orgánica o un huésped). Si no lo encuentran, pueden enquistarse y luego liberar una zoospora secundaria (un fenómeno conocido como polip Planetismo), aumentando sus probabilidades de supervivencia y dispersión. Esta fase es crucial para la rápida colonización y el desarrollo de la reproducción de Saprolegnia.
- Palabras clave: saprolegnia zoospores, saprolegnia flagella.
- Reproducción Sexual: Ocurre en condiciones ambientales menos favorables o cuando diferentes cepas compatibles entran en contacto.
- Se forman estructuras sexuales masculinas (anteridios) y femeninas (oogonios).
- La fecundación da lugar a la formación de oosporas, que son esporas de pared gruesa y alta resistencia.
- Las oosporas pueden permanecer latentes durante largos períodos, sobreviviendo a condiciones adversas (bajas temperaturas, desecación parcial) y germinando cuando las condiciones vuelven a ser favorables. Esta es una de las razones por las que Saprolegnia es tan persistente en los ambientes acuáticos.
La estructura de Saprolegnia, con sus hifas no septadas (cenocíticas) y la producción masiva de zoosporas, contribuye a su éxito como patógeno oportunista. Una descripción visual detallada o un diagrama de Saprolegnia mostraría estas hifas ramificadas y los distintos tipos de esporas.
Factores predisponentes y causas comunes de la Saprolegniasis
La Saprolegniasis raramente afecta a peces sanos en ambientes óptimos. Su aparición está fuertemente ligada a factores que debilitan al huésped o deterioran su entorno, en base a las investigaciones de Tedesco et al., (2022), Sanders (2022) se reportan las siguientes causas:
- Calidad del Agua Deficiente: Es el principal desencadenante. Pavić et al., (2022) reportó sobre cómo los parámetros fisicoquímicos del agua, como el calcio y la conductividad eléctrica, y el fluoruro, así como el estado de salud del huésped (la presencia de lesiones aumenta la carga), influyen en la abundancia de este patógeno oportunista en los ecosistemas de agua dulce y la acuicultura.
- Temperaturas inadecuadas, especialmente descensos bruscos o mantenimiento de temperaturas demasiado frías para especies tropicales.
- Niveles elevados de amoniaco, nitritos, o baja concentración de oxígeno disuelto.
- pH inadecuado o fluctuante.
- Alta carga de materia orgánica en descomposición, que sirve de nutriente inicial para Saprolegnia y deteriora la calidad general del agua.
- Estrés en los Peces: El estrés suprime el sistema inmune, haciéndolos vulnerables.
- Manejo brusco (captura, transporte).
- Alta densidad de población (hacinamiento).
- Aclimatación incorrecta a un nuevo acuario.
- Agresiones por parte de otros peces.
- Cambios ambientales súbitos.
- Lesiones Previas: Cualquier ruptura en la barrera protectora de la piel o mucosidad.
- Heridas físicas, roces contra objetos ásperos.
- Infecciones por ectoparásitos (como Ichthyophthirius o trematodos) que causan heridas.
- Infecciones bacterianas primarias que ulceran la piel.
- Estado Inmunológico Comprometido:
- Mala nutrición o dietas deficientes en vitaminas esenciales.
- Enfermedades concomitantes.
- Edad (peces muy jóvenes o viejos pueden ser más susceptibles).
- Presencia Natural del Patógeno: Las esporas de Saprolegnia están omnipresentes en la mayoría de los cuerpos de agua dulce. La enfermedad se manifiesta cuando los factores anteriores permiten que el patógeno supere las defensas del pez. La pregunta de dónde se encuentra la Saprolegnia tiene una respuesta simple: prácticamente en todos los ambientes acuáticos de agua dulce.
Síntomas y signos clínicos de la Saprolegniasis: Reconociendo la enfermedad del algodón
Identificar tempranamente los síntomas de la Saprolegniasis es vital para un tratamiento exitoso. Los signos más característicos de la «enfermedad del algodón» incluyen:
- Aspecto Algodonoso: Es el signo más evidente. Se observan mechones o parches de aspecto similar al algodón, de color blanco, grisáceo o incluso marrón (si se adhieren detritos del acuario) sobre la piel, aletas, branquias u ojos del pez. Estas son las hifas del oomiceto creciendo sobre el tejido afectado. Palabras clave: saprolegnia en peces, hongo saprolegnia, trucha de agua moho.
- Lesiones Cutáneas:
- Inicialmente pueden aparecer como áreas pálidas o decoloradas en la piel.
- Progresan a erosiones, úlceras y, en casos avanzados, necrosis del tejido.
- Puede haber hemorragias localizadas alrededor de las lesiones.
- Las aletas pueden aparecer deshilachadas o erosionadas.
- Afectación de Huevos: Los huevos infectados se cubren de una masa micelial algodonosa, opacándose y llevando a la muerte del embrión. Esto es un problema grave en piscicultura y para criadores de peces ornamentales.
- Síntomas Comportamentales:
- Letargo o apatía, el pez se muestra menos activo de lo normal.
- Pérdida de apetito.
- Movimientos lentos o natación errática.
- Aislamiento del grupo.
- Algunos peces pueden frotarse contra objetos del acuario en un intento de deshacerse del parásito en las etapas iniciales.
- Casos Severos: Aunque Saprolegnia suele ser una infección superficial, en peces muy debilitados o con especies de Saprolegnia particularmente virulentas, las hifas pueden penetrar más profundamente en los tejidos, llegando a la musculatura. Las infecciones sistémicas son raras pero, de ocurrir, suelen ser rápidamente fatales.

Diagnóstico de la Saprolegniasis: Confirmando la infección
Si bien los signos clínicos algodonosos son muy sugestivos de Saprolegniasis, un diagnóstico preciso puede requerir pasos adicionales, especialmente en entornos de acuicultura o para descartar otras afecciones:
- Examen Macroscópico: La observación directa de las lesiones algodonosas características en la piel, aletas o huevos de los peces es el primer paso y a menudo suficiente para un diagnóstico presuntivo en el contexto de un acuario doméstico.
- Examen Microscópico: Es el método de confirmación más común y accesible.
- Se toma una muestra (raspado o frotis) de la lesión algodonosa.
- Se coloca en un portaobjetos con una gota de agua o solución salina y se observa bajo el microscopio.
- Se buscan las hifas características de Saprolegnia: grandes, anchas, ramificadas y notablemente no septadas (cenocíticas). También se pueden observar zoosporangios en el extremo de algunas hifas, liberando zoosporas.
- Cultivo y Aislamiento: En laboratorios o para investigaciones, las muestras pueden cultivarse en medios de agar específicos (como agar Sabouraud dextrosa o agar harina de maíz) para aislar el oomiceto y permitir una identificación más precisa de la especie.
- Técnicas Moleculares: Para una identificación definitiva a nivel de especie y en estudios epidemiológicos, se utilizan técnicas como la Reacción en Cadena de la Polimerasa (PCR) para amplificar y secuenciar regiones específicas del ADN del oomiceto. El ADN ambiental (eDNA) también se está explorando para detectar la presencia de Saprolegnia en el agua antes de que ocurran brotes visibles. Korkea et al (2022) validaron un ensayo de PCR cuantitativa en tiempo real (qPCR) publicado anteriormente para confirmar la presencia de S. parasitica en peces y en el agua mediante la cuantificación de ADN ambiental (eDNA); mientras que Pavić et al., (2022) desarrolló un ensayo de PCR digital de gotitas (ddPCR) rápido, sensible y específico para detectar y cuantificar el patógeno Saprolegnia parasitica en muestras ambientales.
Diferenciar la Saprolegniasis de infecciones bacterianas columnares (que a veces producen lesiones blanquecinas) o de verdaderos hongos acuáticos (menos comunes como patógenos primarios en peces) es importante para dirigir el tratamiento adecuado.
Especies acuáticas afectadas por Saprolegnia: Un amplio rango de huéspedes
Los oomicetos del género Saprolegnia causan la enfermedad saprolegniasis en los peces, con pérdidas considerables, especialmente en la acuicultura de agua dulce (Korkea et al., 2022) o agua salobre (<2.8 ppm de salinidad), debido a que el daño en la piel o las branquias expone a los peces a ataques secundarios de bacterias y otros hongos (Sanders, 2022).
Saprolegnia no es selectiva con un único tipo de pez; puede afectar a una gran variedad de especies acuáticas, especialmente bajo condiciones de estrés o lesión.
- Peces de Agua Dulce:
- Salmónidos: Son particularmente susceptibles, incluyendo truchas y salmones. La Saprolegniasis es una de las principales causas de pérdidas en la salmonicultura de agua dulce.
- Ciprínidos: Carpas (incluyendo Koi) y goldfish son frecuentemente afectados, especialmente en estanques o acuarios con deficiente calidad de agua.
- Tilapias: La saprolegnia en tilapia es un problema reconocido en granjas de acuicultura.
- Peces Ornamentales Tropicales: Una amplia gama, incluyendo betta, guppy, tetras, cíclidos, entre otros, pueden desarrollar la enfermedad si las condiciones del acuario no son óptimas.
- Peces Gato y otros Siluriformes. Rathod et al., (2024) identificó a Saprolegnia parasitica como un patógeno significativo del pez basa Pangasianodon hypophthalmus, particularmente en condiciones de baja temperatura ambiental que favorecen el crecimiento fúngico y precipitan los brotes invernales
- Anfibios: Muchos anfibios son conocidos por sufrir la muerte de sus embriones como consecuencia de las infecciones por saprolegnia (Fernández et al., 2008); el hongo coloniza las lesiones en la piel pre-existentes en anfibios acuáticos (O’Rourke y Rosenbaum, 2015).
- Ajolotes (Ambystoma mexicanum): Son extremadamente sensibles a la saprolegnia en ajolotes, y las infecciones pueden ser rápidamente fatales si no se tratan. Las lesiones causadas por la saprolegnia suelen ser nódulos oscuros elevados; sin embargo pueden estar ulcerados, y también pueden causar debilitamiento y pérdida de peso.
- Ranas y salamandras: Especialmente sus larvas y huevos pueden ser vulnerables. Fernández et al., (2008) reporta a la especie S. diclina como causante de las infecciones de Saprolegnia en los embriones de “sapo corredor” (Bufo calamita) en las áreas montañosas del centro de España.
- Huevos de Peces y Embriones: Saprolegnia (especialmente S. diclina) es una causa principal de mortalidad en huevos de muchas especies de peces, tanto en la naturaleza como en incubadoras artificiales, formando una densa capa algodonosa que impide el intercambio de oxígeno.
- Crustáceos: Aunque menos común, se han reportado casos de Saprolegniasis en camarones de agua dulce, usualmente como infección secundaria a estrés severo o lesiones.
La susceptibilidad puede variar entre especies e incluso entre individuos de la misma especie, dependiendo de su estado de salud general y las condiciones ambientales.

Tratamiento y control de la Saprolegniasis: Estrategias actualizadas
El tratamiento de la Saprolegnia en peces debe ser rápido y multifacético, abordando tanto al patógeno como los factores predisponentes. El tratamiento para la enfermedad de algodón depende del tipo de pez, la gravedad de la infección y el tamaño del área infectada. Para casos leves, a menudo es suficiente elevar la temperatura en el tanque y mantener una buena calidad del agua. En casos más severos, pueden ser necesarios medicamentos antimicóticos.
Aquí se presentan diversas estrategias, desde medidas inmediatas hasta tratamientos específicos:
Medidas inmediatas y fundamentales
- Aislamiento: Trasladar inmediatamente los peces afectados a un tanque hospital con agua limpia y parámetros óptimos. Esto previene la propagación de zoosporas en el tanque principal y permite un tratamiento más focalizado.
- Mejora de la calidad del agua: Tanto en el tanque principal como en el de hospital, es crucial realizar cambios parciales de agua (25-50%), sifonar el fondo para eliminar detritos y materia orgánica, y verificar/corregir los parámetros clave (temperatura, pH, amoniaco, nitritos). Una buena oxigenación es esencial.
Tratamientos Químicos (Usar con precaución y de acuerdo a la legislación local)
Sal (Cloruro de sodio no yodado)
Es uno de los tratamientos más seguros y accesibles, especialmente para peces ornamentales. Vajargah y Majidiyan (2022) destacan que en el caso de los peces (truchas, salmones, tilapia, carpas, etc) que son consumidos por las personas se recomienda emplear sólo sal. Puedes realizar baños cortos (10-30 g/L por 15-30 minutos) o mantener una concentración baja en el tanque hospital (1-3 g/L) por varios días. Ayuda a restaurar el balance osmótico del pez y tiene efecto antifúngico.
Formalina (Formaldehído)
Históricamente muy utilizado en acuicultura, especialmente para baños (ej. 150-250 ppm por hasta 1 hora). Es efectivo, pero es un químico peligroso que debe manejarse con extrema precaución (guantes, gafas, buena ventilación). Su uso está cada vez más restringido en varios lugares debido a preocupaciones ambientales y de salud.
Permanganato de Potasio (KMnO₄)
Se utiliza en baños cortos (ej. 2-4 ppm por 30-60 minutos). Es un oxidante fuerte que puede ser efectivo, pero una sobredosis es tóxica. El agua se tornará rosada/púrpura; si se vuelve marrón rápidamente, indica alta materia orgánica y puede requerir redosificación o cambio de agua.
Sulfato de Cobre
Efectivo contra oomicetos, pero su toxicidad para los peces varía enormemente con la dureza del agua (alcalinidad). Es más seguro en aguas duras. Investigaciones recientes buscan potenciar su efecto a bajas dosis combinándolo con ionóforos. Requiere un test de cobre para monitorear la concentración. Muchos invertebrados son extremadamente sensibles al cobre.
Ácido bórico
En el caso de los huevos de salmones, Ali et al., (2014) emplearon ácido bórico como una medida profiláctica y para curar la infección del algodón en huevos fertilizados y larvas con saco vitelino. No se observan signos de saprolegniasis en las tilapias del Nilo (Oreochromis niloticus) tratadas con ácido bórico a concentraciones superiores de 0.4 g/L (Ali et al., 2019).
Verde de Malaquita
ESTÁ PROHIBIDO en muchos países para uso en animales destinados a consumo y su uso en ornamentales es altamente desaconsejado debido a su demostrada carcinogenicidad y persistencia ambiental (Kumar et al., (2020). Los mencionamos aquí por su importancia histórica como tratamiento muy efectivo, cuya prohibición ha impulsado la búsqueda de alternativas.
Productos comerciales antifúngicos
Existen diversas formulaciones comerciales diseñadas para tratar infecciones fúngicas y oomicéticas en peces. Es crucial leer y seguir las instrucciones del fabricante al pie de la letra, incluyendo dosis y duración del tratamiento. Algunos pueden contener combinaciones de los químicos mencionados u otros compuestos.
Al respecto, Rathod et al., (2024) reportó que el clotrimazol se destaca como un potencial medicamento veterinario para controlar la micosis superficial debido a su actividad inhibitoria significativa in vitro; este producto mostró una actividad inhibitoria significativa contra el crecimiento de esporas e hifas de Saprolegnia parasitica a una concentración muy baja de 2 mgL⁻¹.
Otros productos químicos
Kumar et al., (2020) encontraron que el triclosán (aprobado por la FDA de EEUU) era más eficaz con una concentración inhibitoria mínima (MIC100) de 4 μg/ml. Asimismo, Tedesco et al., (2018) reporta que en pruebas in vitro el ácido benzoico y el ácido yodoacético mostraron los mejores resultados, y que los productos a base de ácido acético y ácido peracético, en combinación con peróxido de hidrógeno, son candidatos prometedores.
Tratamientos físicos
Heikkinena et al., (2013) reportó que la irradiación UV de alta dosis (400 mWs/cm²) del agua de entrada disminuyó significativamente la mortalidad de los huevos de trucha arco iris (Oncorhynchus mykiss) del 77.3% al 14.3% por causadas por moho de agua Saprolegnia spp.,, durante un ensayo de 28 días.
Por su parte, Johari et al., (2016) evaluó el uso indirecto de nanopartículas de plata (AgNPs) en filtros de agua y reporta que fue significativamente efectivo para prevenir infecciones fúngicas en sistemas de semi-recirculación para truchas arco iris durante el período de incubación.
Tratamientos biológicos
Probióticos
La adición de bacterias beneficiosas al agua o al alimento está siendo investigada como una forma de controlar patógenos y mejorar la salud general de los peces, pudiendo ser una estrategia preventiva contra la Saprolegniasis. Al respecto, Firouzbakhsh et al., (2014) informó que la suplementación dietética (1.0 g kg⁻¹) con un simbiótico en alevines de truchas arcoíris (Oncorhynchus mykiss) aumenta el rendimiento del crecimiento y la tasa de supervivencia contra la infección de Saprolegnia parasitica.
Por otro lado, Lone y Manohar (2018) reportan que Actinobacteria, del género Frondihabitans (Microbacteriaceae) inhibe la adherencia de Saprolegnia a los huevos del salmón.
Extractos de plantas y aceites esenciales
La investigación está explorando compuestos naturales. Por ejemplo, el linalool, un componente de muchos aceites esenciales, ha mostrado actividad anti-Saprolegnia parasitica (Tao et al., 2025); mientras que Tang et al., (2024) informó que el linalool demostró tener una actividad anti-oomicetos eficaz tanto in vitro como in vivo contra Saprolegnia ferax.
Ashraf et al., (2020) reporta que los extractos etanólicos de “granada” Punica granatum y “tomillo” Thymus vulgaris exhibieron una eficacia potencial en la supresión del crecimiento micelial de S. diclina a una concentración de 0,5 mg/ml. En el mismo sentido, los resultados de la investigación de ALsafah y AL-Faragi (2017) indican que la suplementación de la alimentación de la carpa común (Cyprinus carpio) con “tomillo” mejora la inmunidad de los peces ante el desafío de Saprolegnia.
Por su parte, Nardoni et al., (2019) reportan que los aceites esenciales de “Litsea” Litsea cubeba, “citronela” Cymbopogon flexuosum y “pera del Bey” Citrus bergamia, en pruebas in vitro, pueden ser de interés para controlar la Saprolegnia.
Mehrabi et al., (2019) concluyen que el uso 15 gramos del polvo de Aloe vera (Aloe barbadensis) por kilogramo de alimento en trucha arcoíris (Oncorhynchus mykiss) reduce la mortalidad de los peces infectadas con Saprolegnia.
Los resultados del estudio de Elgendy et al., (2022) indican que alimentar a la tilapia con dietas suplementadas con productos de plantas medicinales, como Allium cepa (cebolla), puede mejorar varios aspectos de la salud y el rendimiento de los peces.
El estudio de Aly et al., (2025) concluye que el ajo (1.5%) y la canela (8.5%) pueden servir como inmunoestimulantes eficaces para controlar las infecciones fúngicas en peces, específicamente en la tilapia del Nilo (Oreochromis niloticus).
Fortalecimiento del sistema inmune
Una dieta de alta calidad, rica en vitaminas (especialmente C y E) y otros inmunoestimulantes, puede ayudar a los peces a resistir infecciones. El principal hallazgo del estudio de Alafari et al., (2025) fue que una combinación dietética de nanopartículas de selenio (SeNPs) y Vitamina C (grupo SeNPs + VC100) mejoró sinérgicamente la capacidad antioxidante, la respuesta inmunitaria, la salud de los órganos, el crecimiento y la resistencia a las enfermedades en los peces tilapia (Oreochromis niloticus).
Manejo de infecciones secundarias
Las lesiones causadas por Saprolegnia pueden ser colonizadas por bacterias oportunistas. Si se observan signos de infección bacteriana (enrojecimiento severo, septicemia), puede ser necesario un tratamiento con antibióticos, idealmente prescrito por un veterinario especializado en peces.
Es importante recordar que la cura para la Saprolegnia no solo depende del agente terapéutico, sino de la corrección de los factores ambientales y del estado de salud general del pez. El tratamiento de la Saprolegnia en peces debe ser integral.
Prevención: La mejor estrategia contra la Saprolegnia
Dado que la Saprolegniasis es una enfermedad predominantemente oportunista, la prevención es, con diferencia, la estrategia más efectiva y económica. Las siguientes medidas son fundamentales:
- Mantenimiento impecable de la calidad del agua:
- Realizar cambios parciales de agua regulares (semanales o quincenales, dependiendo de la carga biológica).
- Monitorear periódicamente los parámetros clave: pH, amoniaco, nitritos, nitratos y temperatura.
- Asegurar una filtración biológica, mecánica y química adecuada.
- Sifonar el sustrato para eliminar restos de comida y heces.
- Mantener una buena oxigenación.
- Evitar el estrés:
- Aclimatar cuidadosamente todos los nuevos habitantes al acuario.
- No sobrepoblar el tanque. Cada pez necesita espacio adecuado.
- Proporcionar un ambiente enriquecido con escondites si es necesario para las especies mantenidas.
- Realizar el manejo (captura, traslados) de forma gentil y minimizando el tiempo fuera del agua.
- Mantener la compatibilidad entre especies para evitar agresiones.
- Nutrición óptima:
- Ofrecer una dieta variada, equilibrada y de alta calidad, específica para las necesidades de cada especie.
- Evitar sobrealimentar, ya que los restos de comida no consumida se descomponen y afectan la calidad del agua.
- Cuarentena estricta:
- Todos los peces, plantas y otros organismos nuevos deben pasar por un período de cuarentena (idealmente 4 semanas) en un tanque separado antes de ser introducidos al acuario principal. Esto permite observar y tratar posibles enfermedades sin arriesgar a la población existente.
- Higiene y desinfección:
- Limpiar regularmente los equipos del acuario (filtros, calentadores, decoración).
- Usar redes y herramientas separadas para el tanque de cuarentena y el principal, o desinfectarlas cuidadosamente entre usos.
- Prevención de heridas:
- Asegurarse de que la decoración del acuario no tenga bordes afilados.
- Prevenir agresiones manteniendo especies compatibles.
- Control de parásitos: Tratar prontamente cualquier infestación por parásitos externos, ya que las heridas que causan son puertas de entrada para Saprolegnia.
- Observación diaria: Dedicar tiempo cada día a observar el comportamiento y la apariencia de los peces. La detección temprana de cualquier anomalía es clave para actuar rápidamente.
Impacto de la Saprolegniasis en la acuicultura
La Saprolegniasis no es solo un problema para los acuaristas domésticos; tiene un impacto económico considerable en la industria de la acuicultura a nivel mundial.
- Pérdidas económicas directas:
- Mortalidad de peces en todas las etapas de cultivo, desde huevos y alevines hasta adultos listos para el mercado. Las infecciones en huevos pueden llevar a pérdidas masivas en las piscifactorías.
- Reducción de las tasas de crecimiento y conversión alimenticia en peces afectados subclínicamente.
- Costos asociados al tratamiento (productos químicos, mano de obra).
- Especies de acuicultura afectadas: Salmónidos (trucha arcoíris, salmón del Atlántico) son especialmente vulnerables. También afecta a la producción de tilapia, bagre, carpa y otras especies de importancia comercial.
- Problema reemergente: La incidencia de Saprolegniasis en la acuicultura ha aumentado en algunas regiones tras la prohibición o restricción de uso de tratamientos altamente efectivos pero ambientalmente problemáticos, como el verde de malaquita.
- Desafíos para el control:
- La ubicuidad de Saprolegnia en ambientes de agua dulce hace que su erradicación sea prácticamente imposible.
- La necesidad de tratamientos que sean efectivos, económicamente viables, seguros para los peces, los consumidores y el medio ambiente.
- El desarrollo de resistencia a algunos tratamientos es una preocupación constante.
- Importancia de la bioseguridad y buenas prácticas de manejo: La prevención, a través de la optimización de la calidad del agua, la reducción del estrés, la desinfección de huevos y el manejo cuidadoso, sigue siendo la estrategia más importante para minimizar el impacto de Saprolegnia en la acuicultura.
La investigación continúa enfocada en desarrollar métodos de control más sostenibles y efectivos, incluyendo vacunas (aunque difíciles para oomicetos), inmunoestimulantes, probióticos y el uso de compuestos naturales.
Conclusión
La Saprolegnia, ese «moho acuático» tan temido, es un claro ejemplo de patógeno oportunista. Su presencia en el agua es casi una constante, pero la Saprolegniasis solo se manifiesta cuando las defensas de los peces se ven comprometidas o su entorno se deteriora. La clave para combatir esta enfermedad no reside únicamente en los tratamientos, aunque estos sean necesarios en un brote, sino en un manejo proactivo y preventivo.
Mantener una calidad de agua excepcional, minimizar el estrés de los peces, proporcionar una nutrición adecuada y practicar una buena higiene en el acuario o instalación acuícola son los pilares fundamentales para evitar que la «enfermedad del algodón» se convierta en un problema. La observación atenta y la acción rápida ante los primeros signos son cruciales para proteger la salud y el bienestar de nuestros organismos acuáticos. Un enfoque integrado, que combine la prevención rigurosa con estrategias de tratamiento informadas, es la mejor defensa contra la Saprolegniasis.
Preguntas Frecuentes (FAQ)
¿La Saprolegnia puede afectar a los humanos?
No, Saprolegnia es un patógeno de organismos acuáticos de sangre fría (peces, anfibios) y no se considera una amenaza para la salud humana.
¿Cómo puedo diferenciar la Saprolegnia de otras manchas blancas en mis peces?
La Saprolegniasis típicamente presenta un aspecto algodonoso tridimensional, como mechones. Otras enfermedades como el Ich (Ichthyophthirius multifiliis) se manifiestan como pequeños puntos blancos definidos y planos, como granos de sal. Las infecciones bacterianas columnares pueden parecer manchas blanquecinas, pero a menudo tienen un aspecto más erosionado o necrótico sin el crecimiento filamentoso tan pronunciado. Un examen microscópico puede ser definitivo.
¿Es seguro usar sal común para tratar la Saprolegnia en todos los peces?
La sal (cloruro de sodio no yodado) es un tratamiento de primera línea efectivo y seguro para muchos peces de agua dulce. Sin embargo, algunas especies son más sensibles a la sal que otras (por ejemplo, ciertos peces gato sin escamas o algunas plantas acuáticas). Siempre es mejor investigar la tolerancia a la sal de las especies específicas que se mantienen y aumentar la concentración gradualmente. Los baños cortos en concentraciones más altas suelen ser más seguros que mantener una concentración elevada en el tanque a largo plazo para especies sensibles.
¿Qué tan rápido puede actuar la Saprolegnia?
En condiciones desfavorables para el pez y favorables para el oomiceto, la Saprolegniasis puede desarrollarse y propagarse muy rápidamente, a veces causando daños extensos o la muerte en cuestión de 24 a 72 horas, especialmente en peces pequeños, debilitados o en huevos.
¿Puedo usar medicamentos para hongos humanos en mis peces?
Generalmente no se recomienda. Las formulaciones y dosis para humanos son muy diferentes y podrían ser tóxicas para los peces. Es mejor utilizar productos específicamente diseñados para uso en acuarios y seguir las indicaciones del fabricante o consultar a un veterinario especializado en peces.
Referencias bibliográficas
Alafari, H.A., Albaqami, N.M., Abd El-Aziz, Y.M. et al. The effects of nano-selenium and/or vitamin C on the growth performance, blood health, organ histology, molecular alterations, and disease resistance of Nile tilapia (Oreochromis niloticus) against Saprolegnia ferax. Aquacult Int 33, 65 (2025). https://doi.org/10.1007/s10499-024-01760-5
Ali SE, Thoen E, Evensen Ø, Skaar I (2014) Boric Acid Inhibits Germination and Colonization of Saprolegnia Spores In Vitro and In Vivo. PLoS ONE 9(4): e91878. https://doi.org/10.1371/journal.pone.0091878
Ali, S.E., Gamil, A.A.A., Skaar, I. et al. Efficacy and safety of boric acid as a preventive treatment against Saprolegnia infection in Nile tilapia (Oreochromis niloticus). Sci Rep 9, 18013 (2019). https://doi.org/10.1038/s41598-019-54534-y
Aly, S. M., Elatta, M. A., Nasr, A. A., & Fathi, M. (2025). Efficacy of garlic and cinnamon as an alternative to chemotherapeutic agents in controlling Saprolegnia infection in Nile tilapia. Aquaculture and Fisheries, 10(1), 105-114. https://doi.org/10.1016/j.aaf.2023.07.010
ALsafah Ameer and Jamal AL-Faragi. 2017. Influence of thyme (Thymus vulgaris) as feed additives on growth performance and antifungal activity on Saprolegnia spp. in Cyprinus carpio L. Journal of Entomology and Zoology Studies 2017; 5(6): 1598-1602
Ashraf Abdel-Fattah Mostafa, Abdulaziz Abdulrahman Al-Askar, Mohamed Taha Yassin. 2020. Anti-saprolegnia potency of some plant extracts against Saprolegnia diclina, the causative agent of saprolengiasis, Saudi Journal of Biological Sciences, Volume 27, Issue 6, 2020, Pages 1482-1487, ISSN 1319-562X,
https://doi.org/10.1016/j.sjbs.2020.04.008.
Elgendy, M.Y., Ali, S.E., Abdelsalam, M. et al. Onion (Allium cepa) improves Nile tilapia (Oreochromis niloticus) resistance to saprolegniasis (Saprolegnia parasitica) and reduces immunosuppressive effects of cadmium. Aquacult Int (2022). https://doi.org/10.1007/s10499-022-01035-x
Fernández-Benéitez María José, Manuel Eloy Ortiz-Santaliestra, Miguel Lizana, Javier Diéguez-Uribeondo, Saprolegnia diclina: another species responsible for the emergent disease ‘Saprolegnia infections’ in amphibians, FEMS Microbiology Letters, Volume 279, Issue 1, February 2008, Pages 23–29, https://doi.org/10.1111/j.1574-6968.2007.01002.x
Firouzbakhsh, F., Mehrabi, Z., Heydari, M., Khalesi, M. K. and Tajick, M. A. (2014), Protective effects of a synbiotic against experimental Saprolegnia parasitica infection in rainbow trout (Oncorhynchus mykiss). Aquac Res, 45: 609–618. doi:10.1111/j.1365-2109.2012.03261.x
Forouhar Vajargah Mohammad, Nava Majidiyan. 2022. A review of Saprolegniosis. Journal of Aquaculture & Marine Biology, Volume 11 Issue 1 – 2022
Heikkinena J., S.M. Mustonen, P. Eskelinen, L.-R. Sundberg, A. Von Wright. Prevention of fungal infestation of rainbow trout (Oncorhynchus mykiss) eggs using UV irradiation of the hatching water. Aquacultural Engineering 55 (2013) 9–15
Hendrik van den Berg Albert, Debbie McLaggan, Javier Diéguez-Uribeondo, Pieter van West. 2013. The impact of the water moulds Saprolegnia diclina and Saprolegnia parasitica on natural ecosystems and the aquaculture industry, Fungal Biology Reviews, Volume 27, Issue 2, 2013, Pages 33-42, ISSN 1749-4613,
https://doi.org/10.1016/j.fbr.2013.05.001.
Johari S., M. Kalbassi, M. Soltani, I. Je Yu. Application of nanosilver-coated zeolite as water filter media for fungal disinfection of rainbow trout (Oncorhynchus mykiss) eggs. Aquaculture International, February 2016, Volume 24, Issue 1, pp 23-38.
Korkea-aho, Tiina, Tom Wiklund, Christine Engblom, Anssi Vainikka, and Satu Viljamaa-Dirks. 2022. «Detection and Quantification of the Oomycete Saprolegnia parasitica in Aquaculture Environments» Microorganisms 10, no. 11: 2186. https://doi.org/10.3390/microorganisms10112186
Kumar Sanjiv, Mandal Rahul Shubhra, Bulone Vincent, Srivastava Vaibhav. 2020. Identification of Growth Inhibitors of the Fish Pathogen Saprolegnia parasitica Using in silico Subtractive Proteomics, Computational Modeling, and Biochemical Validation. Front. Microbiol., 16 October 2020, Sec. Fungi and Their Interactions
Volume 11 – 2020 | https://doi.org/10.3389/fmicb.2020.571093
Lone SA, Manohar S (2018). Saprolegnia parasitica, a lethal oomycete pathogen: demands to be controlled. J. Inf. Mol. Biol. 6(2): 36-44. DoI | http://dx.doi.org/10.17582/journal.jimb/2018/6.2.36.44
Mehrabi Zibandeh, Farid Firouzbakhsh, Ghodrat Rahimi-Mianji, Hamed Paknejad. 2019. Immunostimulatory effect of Aloe vera (Aloe barbadensis) on non-specific immune response, immune gene expression, and experimental challenge with Saprolegnia parasitica in rainbow trout (Oncorhynchus mykiss), Aquaculture, Volume 503, 2019, Pages 330-338, ISSN 0044-8486, https://doi.org/10.1016/j.aquaculture.2019.01.025.
Nardoni, Simona, Basma Najar, Baldassare Fronte, Luisa Pistelli, and Francesca Mancianti. 2019. «In Vitro Activity of Essential Oils against Saprolegnia parasitica» Molecules 24, no. 7: 1270. https://doi.org/10.3390/molecules24071270
O’Rourke Dorcas P., Matthew D. Rosenbaum. 2015. Chapter 18 – Biology and Diseases of Amphibians, Editor(s): James G. Fox, Lynn C. Anderson, Glen M. Otto, Kathleen R. Pritchett-Corning, Mark T. Whary, In American College of Laboratory Animal Medicine, Laboratory Animal Medicine (Third Edition), Academic Press, 2015, Pages 931-965, ISBN 9780124095274, https://doi.org/10.1016/B978-0-12-409527-4.00018-3.
Pavić, D., Grbin, D., Hudina, S., Prosenc Zmrzljak, U., Miljanović, A., Košir, R., Varga, F., Ćurko, J., Marčić, Z., & Bielen, A. (2022). Tracing the oomycete pathogen Saprolegnia parasitica in aquaculture and the environment. Scientific Reports, 12(1), 1-11. https://doi.org/10.1038/s41598-022-16553-0
Rathod, S. K., Das, B. K., Tandel, R. S., Chatterjee, S., Das, N., Tripathi, G., Kumar, S., Panda, S. K., Patil, P. K., & Manna, S. K. (2024). Isolation and characterization of Saprolegnia parasitica from cage-reared Pangasianodon hypophthalmus and its sensitivity to different antifungal compounds. Scientific Reports, 14(1), 1-12. https://doi.org/10.1038/s41598-024-80075-0
Tang, T., Zhong, W., Yang, L., He, M., Jiang, S., Yin, D., Guo, J., & Gao, Z. (2024). In vitro and in vivo anti-oomycetes activities and mechanisms of linalool against Saprolegnia ferax. Aquaculture, 578, 740031. https://doi.org/10.1016/j.aquaculture.2023.740031
Tao Tang Weiming Zhong Puyu Tang Rongsi Dai Jiajing Guo Zhipeng Gao (2025) Linalool combats Saprolegnia parasitica infections through direct killing of microbes and modulation of host immune system eLife 13:RP100393. https://doi.org/10.7554/eLife.100393.3
Tedesco, P, Fioravanti, ML, Galuppi, R. In vitro activity of molecules and commercial products against Saprolegnia parasitica and Saprolegnia delica strains. J Fish Dis. 2019; 42: 237– 248. https://doi.org/10.1111/jfd.12923
Tedesco Perla, Marcia Saraiva, Jose Vladimir Sandoval-Sierra, Mickael Teixeira Alves, Roberta Galuppi, Javier Dieguez-Uribeondo, Pieter van West, Alastair Cook, Paulette Posen, Birgit Oidtmann, Marialetizia Fioravanti. 2022. Impact of abiotic factors and husbandry on saprolegniosis in salmonid farms, Aquaculture, Volume 561, 2022, 738679, ISSN 0044-8486, https://doi.org/10.1016/j.aquaculture.2022.738679.
Trusch, F., Loebach, L., Wawra, S. et al. Cell entry of a host-targeting protein of oomycetes requires gp96. Nat Commun 9, 2347 (2018). https://doi.org/10.1038/s41467-018-04796-3
Wikipedia. 2021. Saprolegnia
Editor de la revista digital AquaHoy. Biólogo Acuicultor titulado por la Universidad Nacional del Santa (UNS) y Máster en Gestión de la Ciencia y la Innovación por la Universidad Politécnica de Valencia, con diplomados en Innovación Empresarial y Gestión de la Innovación. Posee amplia experiencia en el sector acuícola y pesquero, habiendo liderado la Unidad de Innovación en Pesca del Programa Nacional de Innovación en Pesca y Acuicultura (PNIPA). Ha sido consultor senior en vigilancia tecnológica, formulador y asesor de proyectos de innovación, y docente en la UNS. Es miembro del Colegio de Biólogos del Perú y ha sido reconocido por la World Aquaculture Society (WAS) en 2016 por su aporte a la acuicultura.