
Por: Milthon B. Lujan y Carmen Chimbor
En los últimos años, las plagas de piojo de mar han causado preocupaciones, no solo por su impacto en la industria acuícola marina (especialmente la salmonicultura), si no también por el reporte de ataques a los bañistas en las playas de Australia.
Este informe tiene como objetivo el de brindar información sobre las variedades de piojo de mar que afectan a la industria de la piscicultura marina, y en particular, a la salmonicultura; además de identificar algunas medidas de control y algunos tratamientos de control que se están empleando contra el piojo de mar en todo el mundo.
¿Qué es un piojo de mar?
Un piojo de mar es un copépodo parásitos, también conocido como piojo marino, pertenecen a la familia Caligidae (Nagasawa 2004); esta familia tiene 30 géneros y 509 especies.
Los géneros de mayor interés son: Lepeophtherius, Caligus y Pseudocaligus, debido a que generan altas mortalidades en la industria acuícola y en algunos casos han sido responsables de infestaciones a bañistas.
Hemmingsen et al., (2020) publicaron una revisión de la distribución geográfica y las preferencias de huéspedes de seis especies de piojo de mar que afectan a la industria salmonera en todo el mundo: C. elongatus, C. curtus, C. clemensi, C. rogercresseyi, C. teres y C. orientalis.

Conociendo al piojo de mar
El desarrollo del piojo de mar es rápido en temperaturas templadas, una generación se completa en casi un mes a una temperatura de 15 oC , produciendo un gran número de huevos, lo que conduce a un rápido incremento de la población y por ende de la infestación.
Los piojos de mar afectan a los salmones, y a todos los peces marinos, de varias formas: pérdida de escamas, lo que hace susceptible al pez a otras enfermedades (O’Donohoe et al, 2004), y daño al pez lo que reduce la calidad del producto. Estos parásitos se alimentan de la piel, mucus y sangre del pez.
Las lesiones causadas por los piojos de mar llevan a desequilibrios osmoregulatorios e infecciones por hongos y bacterias.
Mantente siempre informado
Únete a nuestras comunidades para recibir al instante las noticias, informes y análisis más importantes del sector acuícola.
El piojo de mar comúnmente tiene 10 estados de desarrollo. Estos incluyen dos estados de nauplios de vida libre, un estado de infección copepoid de natación libre, cuatros estados chalimus que se pegan al pez, dos estados pre-adultos, y un estado adulto. Los estados pre-adultos y adultos recorren libremente la superficie del huésped.
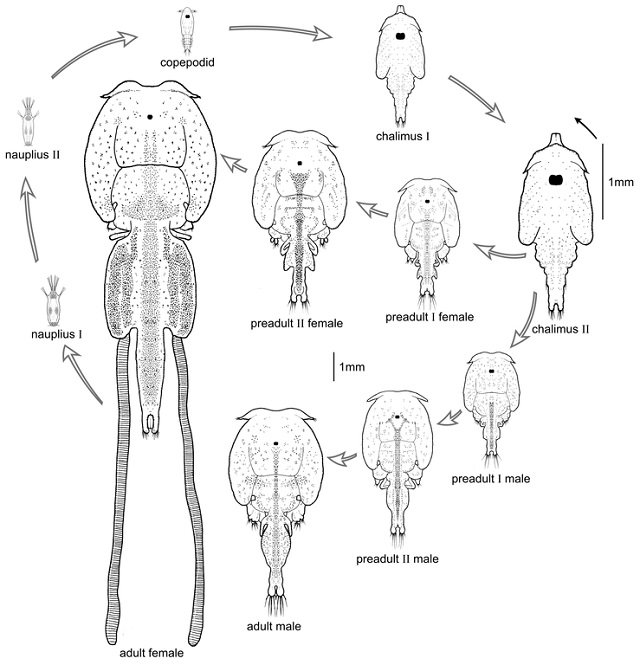
Impactos del piojo de mar en la industria acuícola marina
Una de las principales plagas que afecta a la industria de la piscicultura marina es el piojo de mar. Los copépodos ectoparásitos son los principales patógenos de las granjas de salmónidos en el Noruega, Escocia, Irlanda, Canadá, y Chile.
Abolofia et al. (2017) destaca que el piojo de mar genera pérdidas de la biomasa por ciclo en el cultivo de salmones de 3.62 a 16.55%, y que el costo promedio de los daños generados por los piojos de mar es de US$ 0.46 por kilogramo de biomasa cosechada.
Estos parásitos generan pérdidas significativas a los productores acuícolas, debido a que se reduce la tasa de crecimiento de los peces en cultivo, la calidad de los mismos, y el incremento de los costos de producción por los gastos en el tratamiento de los parásitos.
Por otro lado, el uso de químicos antiparasitarios podría tener impactos negativos sobre las especies acuáticas y el ecosistema que rodea las jaulas de cultivo de los peces marinos. Al respecto, Parson et al., (2020) sugieren que la deltametrina representa un riesgo significativo para las larvas de la langosta europea (Homarus gammarus) en el entorno marino noruego, mientras que el impacto del azametifos puede ser menos grave.
Distribución del piojo de mar
En particular Lepeophtheirus salmones y Caligus elongates son patógenos importantes en Europa y Norteamérica (Nagasawa 2004). No obstante, se han reportado especies del genero Caligus, en todo el mundo; al respecto debemos indicar que los problemas de infestación con piojos de mar, son más notables en países en donde se desarrolla intensivamente la piscicultura marina.
Lepeophtheirus salmonis
Esta especie ha sido encontrada en salmones de Irlanda (O’Donohoe et al, 2004). De acuerdo a Nagasawa (2004) L. salmonis es un parasito común del salmón chum (Oncorhynchus keta ) y del salmón rosa (O. gorbuscha) salvajes de las aguas al norte de Japón; asimismo este parasito también se encuentra en salmónidos de Corea y Rusia. Además Nagasawa (2004) reporta que estas especies de parásitos también se presentan en el salmón coho (O. kisutch) y la trucha arco iris (O. mykiss) criados en las aguas costeras al norte de Japón, pero la infección no es un problema serio debido a que los peces jóvenes son criados y cosechados en menos de un año, así los peces no son cultivados durante el verano.
Por otro lado, en países como Escocia, Irlanda, Noruega y Canadá, L. salmonis causa un daño serio a las granjas de salmón del Atlántico (Nagasawa 2004).
Caligus
O’Donohoe et al (2004), reporta la presencia de C. elongatus en granjas de salmónidos en Irlanda, e indica que infecta a mas de 80 peces marinos. En este sentido, Robaldo et al (2002) sugiere un alto potencial de infestación de lenguados juveniles (P. orbignyanus) por Caligus sp. en el Brasil.
Las especies de piojos de mar del género Caligus son los que causan los mayores problemas en el Sudeste de Asía. C. patulus infesta la piel y branquias del milkfish (Chanos chanos) en estanques de agua salobre en Filipinas e Indonesia.
Dentro de este grupo Caligus orientalis, es un parásito de los peces marinos y de aguas salobres en Japón y países vecinos (Taiwán, China, Corea y Rusia); este parasito ha sido reportado en más de 20 especies de peces de diferentes órdenes y familias C. orientalis ha infestado a peces como trucha arco iris en Japón, lisa (Mugil cephalus) y black porgy (Acanthopagrus schlegeli) en Taiwán, y tilapia de Mozambique (Oreochromis mossambicus) en China (Nagasawa 2004).
Medidas de prevención
Las investigaciones en métodos de prevención de las infestaciones de piojos de mar en la acuicultura no han recibido mayor atención de los investigadores. Los métodos preventivos enfatizan los rasgos de resistencia del huésped y, al mismo tiempo, reducen los encuentros entre el huésped y el parásito (Barrett et al., 2020).
La investigación de Barrett et al., (2020) resume la gama de métodos preventivos potenciales y existentes, entre los cuales destacan la tecnología de barrera con una reducción del 76% en las infestaciones, la gestión espaciotemporal geográfica, la manipulación de la profundidad de natación, los alimentos funcionales, los repelentes y el enmascaramiento de señales del huésped, pueden generar reducciones más pequeñas que pueden ser aditivas cuando se usan en combinación con tecnologías de barrera.
Por otro lado, Coates et al., (2023) desarrollaron un modelo para la metapoblación y la dinámica evolutiva del piojo del salmón (Lepeophtheirus salmonis), y demostraron que los modelos evolutivos pueden producir predicciones cuantitativas en grandes escalas espaciales y temporales y para una variedad de escenarios de control de plagas.
Nutrición
Leclercq et al., (2020) estudio la suplementación de la dieta del salmón con una fracción de levadura rica en manano, y reporta un aumento en la mucosidad de la piel, y la densidad de células caliciformes; lo que permitió una reducción de 16.6% en la susceptibilidad a un desafío agudo de copépodos estándar junto con un aumento anterior en la actividad de la lisozima de la piel ampliamente utilizada como índice de inmunidad innata.
Tecnologías de barrera
Nilsen et al. (2017) documentaron los efectos protectores de los sistemas de cultivo cerrados flotantes para reducir las infestaciones de Lepeoptheirus salmonis y Caligus elongatus en el cultivo del salmón del Atlántico, sin efectos adversos en el crecimiento y mortalidad de los peces.
Por su parte, Oldham (2023) reporta que la eficacia protectora de las barreras de esnórquel se redujo a la mitad en condiciones de salinidad y temperatura subóptimas; y que la condición y el crecimiento de las branquias pueden verse afectados negativamente por las barreras de esnórquel, particularmente cuando hay una haloclina. Sin embargo, también destaca que el uso combinado de barreras de falda y la modificación del comportamiento reducen las infestaciones de piojos en >50% sin impactos negativos en el crecimiento o la condición de las branquias.
Vacunas
Las vacunas han emergido como el método de prevención del piojo de mar con mayor potencial en la industria acuícola. Casuso et al., (2022) evaluaron el uso de tres prototipos de vacunas para combatir al piojo de mar, y concluyen que los peces vacunados mostraron cambios de modulación en procesos biológicos como la regulación biológica, los procesos metabólicos celulares y la producción de energía, que pueden ser fundamentales para las primeras etapas de la respuesta de los peces C. rogercresseyi.
Tratamientos del piojo de mar
Un reciente estudio de Aldrin et al., (2023) evaluó la efectividad de 10 tratamientos contra el piojo de mar, y concluyeron que los tratamientos térmicos, mecánicos y de agua dulce matan el 70,80% de los piojos; además estiman que los tratamientos de alimentación con benzoato de emamectina matan alrededor del 35% de los piojos, mientras que los tratamientos de baño con peróxido de hidrógeno matan alrededor del 74% y los piretroides el 50% de los piojos, y destacan que el tratamiento de baño aprobado recientemente, imidacloprid, mata a más del 98% de los piojos.
A continuación presentamos los enfoques que se están siguiendo para combatir el piojo de mar:
Selección genética
Barrett et al., (2020) destaca que el desarrollo continuo de linajes de salmón resistentes a los piojos puede conducir a mejoras a largo plazo si se mantiene la ganancia genética.
En el mismo sentido, Robledo et al., (2019) describieron un loci de rasgos cuantitativos que afectan la resistencia a los piojos de mar (Caligus rogercresseyi) en el salmón del Atlántico, que explican entre el 7% y 13% de la heredibilidad de este rasgo. En el mismo sentido, Cáceres et al., (2021) identificaron los genes candidatos en el salmón del Atlántico y la trucha arcoíris (Oncorhynchus mykiss) vinculados con la resistencia al piojo de mar.
Por su parte, Gallardo et al., (2019) destacan el conocimiento genómico sobre los hospedantes y piojos de mar, con énfasis en Salmo salar y Oncorhynchus kisutch como especies de peces hospedantes y Caligus rogercresseyi, como principal amenaza que afecta a la industria salmonera chilena.
Métodos bioacusticos
Solé et al., (2021) estudiaron la sensibilidad de los piojos de mar a los sonidos de baja frecuencia y reportan que los estadios de copépodos y chalimus del piojo de mar (Lepeophtheirus salmonis) se vieron afectados por la exposición al sonido; sin embargo, aún se requieren de mayores estudios para que sea un método comercialmente viable.
Control con químicos
Este método es el que más se ha investigado y consecuentemente más desarrollado; sin embargo, la tendencia creciente es a la reducción en el uso de químicos para el control del piojo de mar, por sus impactos ambientales negativos a las especies acuáticas y la salud del ecosistema marino.
Hannisdal et al., (2020) reportan el uso de emamectina, cipermetrina, diflubenzurón y teflubenzurón en la industria salmonera noruega; además se conoce del uso del peróxido de hidrógeno.
Control biológico del piojo de mar
El uso de peces limpiadores para controlar las infestaciones de piojos de mar en las granjas de salmón del Atlántico está muy extendida y se considera una alternativa favorable al bienestar del salmón a los tratamientos de control de eliminación de piojos actuales (Overton et al., 2020); al respecto, la industria salmonera noruega adopto el uso de los peces limpiadores para el control biológico del piojo de mar (Barrett et al., 2020b).
Powell et al., (2018) destacan el uso de Lumpfish (Cyclopterus lumpus) para que coman los piojos de mar en los salmones de crianza, y describen los desafíos que aún debe superar para que sea una opción viable para la industria salmonera. En el mismo sentido, Brooker et al., (2018) describen la crianza de ballan wrasse (Labrus bergylta) y lumpfish (Cyclopterus lumpus).
En la actualidad, se estima que se emplean aproximadamente 50 millones de peces limpiadores solo en la industria salmonera noruega (Barrett et al., 2020b); sin embargo, Overton et al., (2020) describe que las eficacias reportadas en el uso de peces limpiadores permiten reducciones del 28% al 100% en el número de piojos de mar.
Al respecto, Gentry et al., (2020) destaca que la eficiencia en el uso de los peces limpiadores en las jaulas de crianza comercial de salmón del Atlántico depende principalmente de las estrategias de prevención utilizadas.
Desafíos y perspectivas
Los métodos químicos terapéuticos son los más usados para controlar las infestaciones de piojo de mar;
Por otro lado, se ha prestado poca atención a la selección genética como un método de control del piojo de mar. Aun cuando podría ser un método interesante si se le suma a las medidas de prevención adecuados.
El control de las infestaciones con piojo de mar, van a depender del uso combinado de medidas preventivas y métodos químicos; no obstante, se debe prestar atención a la potencial resistencia que podría generar el piojo de mar al tratamiento químico.
Se deben explorar medidas efectivas de control del piojo de mar, debido a que este organismo tiene la capacidad de parasitar a diferentes especies de peces y por ende también se constituyen en una amenaza para cualquier piscicultura marina que se desee promover en el futuro.
Conclusión
El piojo de mar es una de las principales amenazadas para la industria salmonera en todo el mundo; sin embargo, se vienen realizando avances significativos en los métodos de prevención y control. Además, se cuenta con el genoma de algunas especies de piojo de mar como Caligus rogercresseyi (Nuñez-Acuña et al., 2023) que ayudarán a combatir las infestaciones de este parásito.
Entre las medidas de prevención la nutrición, las tecnologías de barrera y las vacunas son las que muestran el mayor potencial. Por su parte, los tratamientos, como la genética, el uso de peces limpiadores, o métodos acústicos son los más prometedores.
Los estudios en la biología, prevención y tratamiento del piojo de mar se han intensificado y ahora se cuenta con modelos para estudiarlos.
Referencias Bibliograficas
Abolofia, J., Asche, F., & Wilen, J. E. (2017). The cost of lice: quantifying the impacts of parasitic sea lice on farmed salmon. Marine Resource Economics, 32(3), 329-349.
Aldrin M., R.B. Huseby, L.C. Stige, K.O. Helgesen. 2023. Estimated effectiveness of treatments against salmon lice in marine salmonid farming, Aquaculture, Volume 575, 2023, 39749, ISSN 0044-8486, https://doi.org/10.1016/j.aquaculture.2023.739749.
Barrett, L.T., Oppedal, F., Robinson, N. and Dempster, T. (2020), Prevention not cure: a review of methods to avoid sea lice infestations in salmon aquaculture. Rev. Aquacult., 12: 2527-2543. https://doi.org/10.1111/raq.12456
Barrett, L. T., Overton, K., Stien, L. H., Oppedal, F., & Dempster, T. (2020b). Effect of cleaner fish on sea lice in Norwegian salmon aquaculture: a national scale data analysis. International journal for parasitology, 50(10-11), 787-796.
Brooker, A.J., Papadopoulou, A., Gutierrez, C., Rey, S., Davie, A. and Migaud, H. (2018), Sustainable production and use of cleaner fish for the biological control of sea lice: recent advances and current challenges. Veterinary Record, 183: 383-383. https://doi.org/10.1136/vr.104966
Cáceres, P., Barría, A., Christensen, K.A. et al. Genome-scale comparative analysis for host resistance against sea lice between Atlantic salmon and rainbow trout. Sci Rep 11, 13231 (2021). https://doi.org/10.1038/s41598-021-92425-3
Casuso, A.; Valenzuela-Muñoz, V.; Benavente, B.P.; Valenzuela-Miranda, D.; Gallardo-Escárate, C. Exploring Sea Lice Vaccines against Early Stages of Infestation in Atlantic Salmon (Salmo salar). Vaccines 2022, 10, 1063. https://doi.org/10.3390/vaccines10071063
Coates, A., Robinson, N. A., Dempster, T., Johnsen, I., & Phillips, B. L. (2023). Evolutionary predictions for a parasite metapopulation: Modelling salmon louse resistance to pest controls in aquaculture. Evolutionary Applications, 00, 1–17. https://doi.org/10.1111/eva.13618
Gallardo-Escárate, C., Arriagada, G., Carrera, C., Gonçalves, A.T., Nuñez-Acuña, G., Valenzuela-Miranda, D. and Valenzuela-Muñoz, V. (2019), The race between host and sea lice in the Chilean salmon farming: a genomic approach. Rev Aquacult, 11: 325-339. https://doi.org/10.1111/raq.12334
Gentry K, Bui S, Oppedal F, Dempster T (2020) Sea lice prevention strategies affect cleaner fish delousing efficacy in commercial Atlantic salmon sea cages. Aquacult Environ Interact 12:67-80. https://doi.org/10.3354/aei00348
Hannisdal, R., Nøstbakken, O. J., Hove, H., Madsen, L., Horsberg, T. E., & Lunestad, B. T. (2020). Anti-sea lice agents in Norwegian aquaculture; surveillance, treatment trends and possible implications for food safety. Aquaculture, 521, 735044.
Hemmingsen, W., MacKenzie, K., Sagerup, K., Remen, M., Bloch-Hansen, K., & Imsland, A. K. D. (2020). Caligus elongatus and other sea lice of the genus Caligus as parasites of farmed salmonids: a review. Aquaculture, 522, 735160.
Leclercq, E., Pontefract, N., Rawling, M., Valdenegro, V., Aasum, E., Andujar, L. V., … & Merrifield, D. (2020). Dietary supplementation with a specific mannan-rich yeast parietal fraction enhances the gut and skin mucosal barriers of Atlantic salmon (Salmo salar) and reduces its susceptibility to sea lice (Lepeophtheirus salmonis). Aquaculture, 529, 735701.
Nagasawa K. 2004. Sea Lice, Lepeophtheirus salmonis and Caligus orientalis (Copepoda: Caligidae), of Wild and Farmed Fish in Sea and Brackish Waters of Japan and Adjacent Regions: A Review . Zoological Studies 43(2): 173-178.
Nilsen, A., Nielsen, K. V., Biering, E., & Bergheim, A. (2017). Effective protection against sea lice during the production of Atlantic salmon in floating enclosures. Aquaculture, 466, 41-50.
Núñez-Acuña, G., Sáez-Vera, C., Valenzuela-Miranda, D., Valenzuela-Muñoz, V., & Gallardo-Escárate, C. (2023). Whole-genome resequencing in the sea louse Caligus rogercresseyi uncovers gene duplications and copy number variants associated with pesticide resistance. Frontiers in Marine Science, 10, 680.
O’Donohoe P., S. Kennedy, F. Kane, O. Naughton, D. Tierney, L. Copley and D. Jackson. 2004. National Survey of Sea lice (Lepeophtheirus salmonis Krøyer and Caligus elongatus Nordmann) on Fish Farms in Ireland – 2003 . Aquaculture and Catchment Management Services, Marine Institute. 34 p.
Oldham Tina. 2023. Salinity and temperature alter the efficacy of salmon louse prevention, Aquaculture, Volume 575, 2023, 739673, ISSN 0044-8486, https://doi.org/10.1016/j.aquaculture.2023.739673.
Overton K, Barrett LT, Oppedal F, Kristiansen TS, Dempster T (2020) Sea lice removal by cleaner fish in salmon aquaculture: a review of the evidence base. Aquacult Environ Interact 12:31-44. https://doi.org/10.3354/aei00345
Parsons, A. E., Escobar-Lux, R. H., Sævik, P. N., Samuelsen, O. B., & Agnalt, A. L. (2020). The impact of anti-sea lice pesticides, azamethiphos and deltamethrin, on European lobster (Homarus gammarus) larvae in the Norwegian marine environment. Environmental Pollution, 264, 114725.
Powell, A., Treasurer, J.W., Pooley, C.L., Keay, A.J., Lloyd, R., Imsland, A.K. and Garcia de Leaniz, C. (2018), Use of lumpfish for sea-lice control in salmon farming: challenges and opportunities. Rev Aquacult, 10: 683-702. https://doi.org/10.1111/raq.12194
Robaldo R., J. Pereira, L. Sampaio, V. Kütter & A. Bianchini. 2002. Ovoposição e desenvolvimento inicial de Caligus sp. (Copepoda: Caligidae) parasita de juvenis do linguado Paralichthys orbignyanus (Teleostei: Paralichthyidae) em cativeiro. Atlântica, Rio Grande, 24(2): 85-88.
Robledo, D., Gutiérrez, A. P., Barría, A., Lhorente, J. P., Houston, R. D., & Yáñez, J. M. (2019). Discovery and functional annotation of quantitative trait loci affecting resistance to sea lice in Atlantic salmon. Frontiers in genetics, 10, 56.
Solé, M.; Lenoir, M.; Fortuño, J.-M.; De Vreese, S.; van der Schaar, M.; André, M. Sea Lice Are Sensitive to Low Frequency Sounds. J. Mar. Sci. Eng. 2021, 9, 765. https://doi.org/10.3390/jmse9070765
Todd C. 2006. The copepod parasite (Lepeophtheirus salmonisCaligus elongatus Nordmann) interactions between wild and farmed Atlantic salmon (Salmo salar L.) and wild sea trout (Salmo trutta L.): a mini review (Krøyer), . Journal of Plankton Research 29(1): 61-71.
Treasurer J. 2002. A review of potential pathogens of sea lice and the application of cleaner fish in biological control . Pest Management Science 58 (6): 546-558.
Editor de la revista digital AquaHoy. Biólogo Acuicultor titulado por la Universidad Nacional del Santa (UNS) y Máster en Gestión de la Ciencia y la Innovación por la Universidad Politécnica de Valencia, con diplomados en Innovación Empresarial y Gestión de la Innovación. Posee amplia experiencia en el sector acuícola y pesquero, habiendo liderado la Unidad de Innovación en Pesca del Programa Nacional de Innovación en Pesca y Acuicultura (PNIPA). Ha sido consultor senior en vigilancia tecnológica, formulador y asesor de proyectos de innovación, y docente en la UNS. Es miembro del Colegio de Biólogos del Perú y ha sido reconocido por la World Aquaculture Society (WAS) en 2016 por su aporte a la acuicultura.





