El Megalocytivirus, perteneciente a la familia Iridoviridae, se ha consolidado como uno de los patógenos virales más preocupantes para la acuicultura mundial, afectando a más de 100 especies de peces tanto de agua dulce como marinos, incluyendo peces comestibles y ornamentales. Este virus de ADN de doble cadena causa pérdidas económicas significativas y su manejo representa un desafío constante para la industria de la acuicultura.
Una reciente revisión científica, publicado en la revista Reviews in Aquaculture por científicos de la Sun Yat-Sen University, compila el conocimiento actual sobre Megalocytivirus, su epidemiología, patogenicidad, evasión inmune y las cruciales estrategias de prevención, información vital para productores, técnicos e investigadores del sector.
- 1 ¿Qué es el Megalocytivirus y Cómo se Clasifica?
- 2 Epidemiología: Alcance Global y Especies Susceptibles
- 3 Patogenicidad y Signos Clínicos: ¿Cómo Afecta el Virus a los Peces?
- 4 El Papel Crucial del Ambiente
- 5 Estrategias de Prevención y Control: Presente y Futuro
- 6 Conclusiones y Perspectivas Futuras
- 7 Entradas relacionadas:
¿Qué es el Megalocytivirus y Cómo se Clasifica?
Los Megalocytivirus son virus grandes (120-200 nm de diámetro) con simetría icosaédrica. Actualmente, se reconocen principalmente dos especies virales dentro de este género:
- Megalocytivirus pagrus 1: Incluye tres genotipos distintos:
- Virus de la necrosis infecciosa del bazo y riñón (ISKNV – Infectious spleen and kidney necrosis virus).
- Iridovirus de la dorada japonesa (RSIV – Red seabream iridovirus).
- Iridovirus del rodaballo (TRBIV – Turbot reddish body iridovirus). La infección por Megalocytivirus pagrus 1 es de notificación obligatoria a la Organización Mundial de Sanidad Animal (WOAH).
- Megalocytivirus lates 1: Comprende un solo genotipo conocido como el virus de la enfermedad de la caída de escamas (SDDV – Scale drop disease virus).
Recientemente, se han propuesto otras especies como el Iridovirus del cacho europeo (ECIV) y el Iridovirus del espinoso (TSIV).
Epidemiología: Alcance Global y Especies Susceptibles
Distribución Geográfica
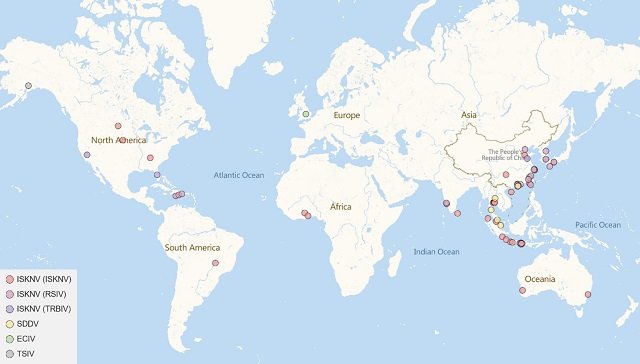
El Megalocytivirus tiene una distribución prácticamente mundial, habiéndose detectado en todos los continentes excepto la Antártida. Asia ha sido particularmente afectada, con brotes reportados desde Japón hasta China, Corea, Tailandia, India y Malasia, donde incluso se han identificado nuevas cepas como el SDDV en lubina asiática (Lates calcarifer). Aunque considerado libre del virus, Australia ha detectado casos importados y permanece en riesgo.
En Europa, aunque menos frecuente, se ha encontrado en peces ornamentales importados y en peces de investigación como el pez cebra en España, e incluso cepas autóctonas como el ECIV en Inglaterra.
América del Norte ha visto casos en peces ornamentales y silvestres (EE.UU., Canadá, Alaska) y, más recientemente, brotes significativos en tilapia cultivada y pámpano en Centroamérica. En Sudamérica, Brasil ha reportado infecciones por ISKNV en tilapia, mientras que África experimentó el primer brote devastador de ISKNV en tilapia en Ghana.
Amplio Rango de Hospedadores
La capacidad del Megalocytivirus para infectar a una vasta gama de especies es notable. Se ha documentado en más de 180 especies de peces pertenecientes a al menos 11 órdenes taxonómicos distintos (Perciformes, Cypriniformes, Siluriformes, Pleuronectiformes, entre otros).
- ISKNV: Detectado en especies de al menos 7 órdenes y 22 familias. Causa alta mortalidad, especialmente en peces como el pez mandarín (Siniperca chuatsi) y, recientemente, en tilapia, el segundo pez más cultivado globalmente.
- RSIV: Reportado en peces de al menos 5 órdenes y 17 familias, principalmente marinos.
- TRBIV: Afecta predominantemente a peces planos (Pleuronectiformes) y Perciformes.
- SDDV: Aunque más reciente, se ha aislado de lubina asiática (Lates calcarifer), sargo amarillo (Acanthopagrus latus) y cacho europeo (Squalius cephalus).
Los peces del orden Perciformes parecen ser particularmente susceptibles.
Mantente siempre informado
Únete a nuestras comunidades para recibir al instante las noticias, informes y análisis más importantes del sector acuícola.
Modos de Transmisión
La principal vía de diseminación es la transmisión horizontal. Estudios de cohabitación en laboratorio han demostrado que el virus puede pasar entre individuos de la misma o diferente especie.
El estudio reporta que se ha confirmado la transmisión de ISKNV por inyección intraperitoneal, inyección muscular, inmersión, vía oral y cohabitación en pez mandarín. Es crucial destacar la capacidad de transmisión entre peces de agua dulce y marinos, facilitada potencialmente por el comercio global de peces ornamentales, que actúa como un importante vector de dispersión, especialmente para virus tipo ISKNV. Estos virus han sido detectados en peces ornamentales en más de 10 países, con riesgo de propagación a especies silvestres. El virus también puede sobrevivir en el agua hasta 48 horas, permitiendo la transmisión indirecta.
Patogenicidad y Signos Clínicos: ¿Cómo Afecta el Virus a los Peces?
El Megalocytivirus causa enfermedades graves con altas tasas de mortalidad, que pueden superar el 90% en pez mandarín, 40-50% en lubina asiática, 20-80% en meros, 60-90% en tilapia, e incluso 100% en pargo japonés (Oplegnathus fasciatus) o 70% en rodaballo (Scophthalmus maximus) infectados con cepas específicas.
Los signos clínicos típicos incluyen:
- Anoxia (falta de oxígeno), anorexia (pérdida de apetito).
- Patrones de natación erráticos.
- Hemorragias externas (cabeza, opérculos, mandíbula, base de aletas).
- Alteraciones del color corporal, erizamiento y pérdida de escamas.
- Exceso de mucus, congestión branquial, hemorragias musculares.
- Hinchazón y erosión del bazo y riñón (órganos clave afectados).
- Ascitis (acumulación de líquido en la cavidad abdominal).
Histopatológicamente, se observa necrosis extensa, vacuolización e inflamación en órganos internos (bazo, riñón, hígado, estómago). Un signo característico es la presencia de células agrandadas (hipertrofiadas) con inclusiones basofílicas, repletas de partículas virales, especialmente en bazo y riñón. Curiosamente, este agrandamiento celular podría estar relacionado con la virulencia del virus.
El Papel Crucial del Ambiente
Factores ambientales como la temperatura del agua son determinantes en los brotes de Megalocytivirus.
- Temperaturas cálidas favorecen la enfermedad: Para ISKNV en pez mandarín, la enfermedad y mortalidad ocurren a temperaturas >25°C, mientras que a 15-20°C no hay signos clínicos. Similarmente, TRBIV en rodaballo causa mortalidad al 60% a 22°C y 100% a 25°C, pero no a 20°C o 17°C. Los brotes de RSIV suelen coincidir con temperaturas >25°C.
- Persistencia a bajas temperaturas: Aunque los peces no muestren signos a bajas temperaturas (ej. 13°C), el virus puede detectarse, indicando que puede persistir en el hospedador y causar brotes cuando las condiciones son favorables.
- Cambios bruscos de temperatura: Pueden estresar a los peces, disminuyendo su respuesta inmune y haciéndolos más susceptibles.
Según el estudio, recientemente, se ha descubierto que los bajos niveles de oxígeno disuelto (hipoxia) (< 2 mg/L) también son un factor crítico que puede desencadenar brotes de ISKNV. La hipoxia activa la vía del factor inducible por hipoxia (HIF)-1 en el pez. El virus ISKNV parece «secuestrar» esta vía, utilizando elementos de respuesta a hipoxia en su propio genoma y proteínas virales (como VP077R) para desmantelar los mecanismos inhibitorios de la vía HIF, aumentando así su propia replicación. Esto subraya la importancia de mantener niveles óptimos de oxígeno disuelto en los cultivos.
Estrategias de Prevención y Control: Presente y Futuro
Dada la complejidad del Megalocytivirus, su control requiere un enfoque multifacético.
Diagnóstico: Detectar a Tiempo es Clave
La detección temprana es fundamental. Se han desarrollado diversas técnicas diagnósticas:
- Métodos tradicionales: Histopatología (observación de células agrandadas), cultivo celular en líneas sensibles, inmunofluorescencia.
- PCR (Reacción en Cadena de la Polimerasa): Ampliamente usada, incluyendo PCR anidada para mayor sensibilidad.
- Avances recientes:
- PCR Multiplex: Permite detectar y diferenciar varios genotipos virales simultáneamente.
- Secuenciación del Genoma Completo (WGS): Usando enfoques como tiled-PCR, crucial para entender la variación genómica y evolución viral.
- PCR en Tiempo Real (qPCR): Ensayos basados en TaqMan ofrecen alta sensibilidad y especificidad para cuantificar la carga viral.
- PCR Digital (ddPCR): Ultra-sensible, capaz de detectar cargas virales muy bajas, útil para diagnóstico precoz.
- Amplificación Isotérmica: Técnicas como RPA combinadas con CRISPR/Cas12a ofrecen detección rápida, sensible y visual, ideal para campo.
- ADN Ambiental (eDNA): Permite detectar el virus en el agua antes de que aparezcan signos clínicos, prometedor para vigilancia proactiva.
- Amplificación por Cebado Cruzado (CPA): Combinada con detección colorimétrica, simple y costo-efectiva.
Estos avances mejoran significativamente la capacidad de detección rápida y precisa, facilitando estrategias de manejo más efectivas.
Vacunación: La Herramienta Más Efectiva
El estudio destaca que la vacunación es una de las estrategias preventivas más potentes. Se ha logrado un progreso considerable en el desarrollo de vacunas contra Megalocytivirus:
- Vacunas Inactivadas (muertas):
- Basadas en virus inactivados (ej. con formalina). Han demostrado alta eficacia (>90%) y protección cruzada entre cepas (ISKNV y RSIV) en diversas especies (dorada, pez mandarín, lubina moteada, lubina asiática).
- Vacunas inactivadas comerciales para RSIV (Japón) e ISKNV (China) ya están disponibles.
- Desventaja: Suelen requerir administración por inyección, lo que implica manejo individual y estrés.
- Vacunas de Subunidad:
- Utilizan proteínas virales recombinantes específicas (ej. Proteína Mayor de la Cápside – MCP). Han mostrado eficacia protectora (ej. 64.3% para ISKNV MCP). Pueden mejorarse con adyuvantes o vehículos como nanopartículas.
- También suelen administrarse por inyección.
- Vacunas de ADN:
- Introducen genes virales (ej. gen mcp u otros ORFs) en plásmidos. Han demostrado reducir significativamente la mortalidad (ej. 50% para ISKNV orf093).
- Generalmente por inyección, aunque se investiga la administración oral con nanopartículas.
- Vacunas Vivas Atenuadas (deleción génica):
- Consideradas muy prometedoras, especialmente para inmunización por inmersión.
- Se crean eliminando genes clave de virulencia del virus (ej. orf069L, orf022L, orf103r/tk, orf074r).
- Estos virus modificados tienen virulencia reducida pero aún pueden replicarse limitadamente en el hospedador, induciendo una fuerte y duradera inmunidad.
- Han demostrado altas tasas de protección (>95%-100%) en pez mandarín, incluso administradas por inmersión.
- La temperatura de inmunización puede ser clave para atenuar aún más la virulencia residual de algunas cepas (ej. inmunizar a 22°C en lugar de 28°C), haciéndolas más seguras y aptas para modelos de cultivo industrializado con control de temperatura.
- Nano-vacunas:
- Utilizan nanomateriales (ej. nanotubos de carbono, quitosano) como vehículos o adyuvantes para mejorar la entrega y respuesta inmune, especialmente para vacunas de subunidad o ADN administradas por inmersión o vía oral. Han mostrado resultados prometedores en protección (70-89%).
- Vacunas de Vector Viral:
- Utilizan otros virus (ej. baculovirus) modificados para expresar proteínas de Megalocytivirus. Han mostrado protección en estudios preliminares.
Es crucial desarrollar protocolos de vacunación específicos para cada instalación y especie, y monitorizar regularmente la efectividad del programa y el estado inmune de los peces.
Estrategias de Manejo Integrado
La vacunación debe complementarse con otras estrategias:
- Bioseguridad Rigurosa: Medidas para prevenir la entrada y diseminación del virus (cuarentena, desinfección de equipos, control de vectores). Seguir las directrices de la WOAH.
- Manejo de la Calidad del Agua: Mantener parámetros óptimos, especialmente temperatura y niveles de oxígeno disuelto.
- Nutrición y Salud: Mantener a los peces en óptimas condiciones nutricionales y de salud general.
- Manejo de la Enfermedad:
- Aislamiento y Tratamiento: Separar inmediatamente los peces afectados. Una práctica común para ISKNV es cesar la alimentación al detectar la infección, lo que parece reducir la mortalidad, aunque el mecanismo no está claro.
- Desinfección: Limpieza y desinfección exhaustiva de las instalaciones afectadas con agentes efectivos (ej. hipoclorito de sodio, ácido peracético, benzalconio, UV, cambios de pH, calor).
- Producción de Semilla Libre de Patógenos Específicos (SPF): Es una estrategia vital a largo plazo. Implica seleccionar reproductores libres del virus, mantenerlos en ambientes controlados y aislados, con pruebas regulares y certificación. Ya hay esfuerzos en marcha para producir semilla SPF de pez mandarín en China.
- Desarrollo de Líneas Resistentes: Utilizar herramientas de selección genética o edición génica (como CRISPR-Cas9) para desarrollar poblaciones de peces más resistentes a la enfermedad. Requiere consideración ética y ambiental.
Conclusiones y Perspectivas Futuras
Megalocytivirus sigue siendo un desafío significativo para la sostenibilidad de la acuicultura. Aunque se ha avanzado mucho en entender su biología y desarrollar herramientas de control, la erradicación efectiva sigue siendo esquiva.
Las investigaciones futuras deben enfocarse en:
- Entender mejor la variación genética viral y los mecanismos de transmisión entre especies.
- Profundizar en las interacciones ambiente-virus-hospedador, especialmente el rol de factores como la hipoxia.
- Desarrollar vacunas orales y de inmersión más efectivas y prácticas, especialmente para larvas y peces pequeños.
- Avanzar en la producción de semilla SPF y en la selección/edición genética para resistencia.
Tecnologías de vanguardia como la secuenciación nanopore para vigilancia genómica, modelos de aprendizaje profundo para predecir rangos de hospedadores, organoides acuáticos para estudiar interacciones, y CRISPR-Cas9 para validar factores clave y desarrollar terapias, serán fundamentales.
La combinación de investigación avanzada, desarrollo de vacunas innovadoras y la implementación rigurosa de estrategias de manejo integrado y bioseguridad allanarán el camino para un control más efectivo de las enfermedades causadas por Megalocytivirus, asegurando un futuro más sostenible para la acuicultura.
Contacto
Jianguo He
School of Marine Sciences, State Key Laboratory for Biocontrol & Southern Marine Science and Engineering Guangdong Laboratory (Zhuhai), Guangdong Province Key Laboratory of Aquatic Economic Animals & Guangdong Provincial Observation and Research Station for Marine Ranching of the Lingdingyang Bay, School of Life Sciences, Sun Yat-Sen University, Guangzhou, People’s Republic of China
Email: lsshjg@mail.sysu.edu.cn
Referencia (acceso abierto)
Guo, C., He, J., Xu, X., Weng, S., & He, J. (2025). Megalocytivirus: A Review of Epidemiology, Pathogenicity, Immune Evasion, and Prevention Strategies. Reviews in Aquaculture, 17(3), e70025. https://doi.org/10.1111/raq.70025
Editor de la revista digital AquaHoy. Biólogo Acuicultor titulado por la Universidad Nacional del Santa (UNS) y Máster en Gestión de la Ciencia y la Innovación por la Universidad Politécnica de Valencia, con diplomados en Innovación Empresarial y Gestión de la Innovación. Posee amplia experiencia en el sector acuícola y pesquero, habiendo liderado la Unidad de Innovación en Pesca del Programa Nacional de Innovación en Pesca y Acuicultura (PNIPA). Ha sido consultor senior en vigilancia tecnológica, formulador y asesor de proyectos de innovación, y docente en la UNS. Es miembro del Colegio de Biólogos del Perú y ha sido reconocido por la World Aquaculture Society (WAS) en 2016 por su aporte a la acuicultura.