Los peces proporcionan sistemas adecuados para los procedimientos de edición del genoma. Los experimentos de edición del genoma con los peces de granja se han enfocado en mejorar la tasa de crecimiento y la resistencia a enfermedades.
La intensificación de la producción acuícola puede contribuir al bienestar humano. La intensificación en la acuicultura puede ser alcanzada mediante la mejora de los sistemas de producción y mediante la mejora genética de los peces de cultivo.
Eric Hallerman, investigador del Department of Fish and Wildlife Conservation de la Virginia Polytechnic Institute and State University de publicó una revisión científica sobre los avances en el progreso técnico de la edición del genoma de los peces de granja, y caracterizó las regulaciones, aceptación del consumidor y los problemas de infraestructura que enfrenta la adopción de las líneas de especies acuícolas con genoma editados por el sector de la acuicultura comercial.
A continuación te ofrecemos un resumen de la publicación, cuyo acceso puedes encontrar al final de este artículo; también puedes encontrar mayor información sobre el potencial de la edición del genoma para la acuicultura aquí.
Avances en los métodos de edición del genoma para los peces
Los peces tienen alta fecundidad, que varía de cientos (tilapias) a miles (la mayoría de peces de agua dulce) y muchos miles (la mayoría de peces marinos) de huevos por ovulación. Los protocolos de inducción al desove existen para muchas especies de cultivo. La fertilización es externa, y fácil de realizar in vitro.
Los huevos de los peces son similares a los de los mamíferos, y son manejables para la microinyección, electroporación, y otros protocolos para introducir constructos de ADN.
Para las especies acuícolas, los tiempos de generación varía de uno (tilapias) a varios años (carpas, salmónidos, bagres). Esta historia de vida y de cultivo contribuye a que los peces se constituyan en los sistemas más adecuados para las modificaciones genéticas, incluido la edición del genoma.
Principio y aplicación de la edición del genoma
La edición del genoma en los peces podría abordarse mediante el uso de nucleasas de dedos de zinc (ZFN), nucleasas efectoras de tipo activador de la transcripción (TALEN) o CRISPR-Cas9.
Todas las herramientas de edición del genoma emplean la tecnología de nucleasa dirigida al sitio (SDN) para realizar una ruptura dirigida de ADN. El proceso de unión de extremos no homólogos (NHEJ) o de reparación dirigida por homología (HDR) del huésped vuelve a ligar la rotura de la doble hebra.
La reparación espontánea de esta ruptura puede provocar una mutación o deleción, provocando el silenciamiento de genes, desactivación de genes o un cambio de la actividad del gen.
Las aplicaciones de tecnología de nucleasa dirigida al sitio (SDN) se dividen conceptualmente en tres categorías:
i) SDN-1 produce una ruptura bicatenaria en el genoma del huésped sin adición de ADN extraño. La reparación espontánea de esta ruptura puede provocar una mutación o deleción, provocando silenciamiento de genes, desactivación de genes o un cambio en la actividad de un gen.
ii) SDN-2 produce una rotura bicatenaria y se suministra una pequeña plantilla de nucleótidos que es complementaria al área de la rotura, que a su vez es utilizada por la células para reparar la rotura. La plantilla contiene de uno a varios pequeños cambios de secuencia en el código genómico, que el mecanismo de reparación del ADN del huésped copia en el genoma del huésped, lo que resulta en una mutación del gen diana.
iii) SDN-3 también induce una ruptura de doble hebra en el ADN, pero va acompañado de una plantilla que contiene un gen u otra secuencia de material genético. El sistema de reparación del ADN de la célula utiliza esta plantilla para reparar la rotura, lo que da como resultado la introducción de nuevo material genético.
Los investigadores están a la búsqueda de nuevas herramientas para mejorar la eficiencia de la edición y reducir las tasas de mutaciones no deseadas, lo que conduce al desarrollo de una nueva clase de editores del genoma, llamados editores bases.
Incremento del crecimiento y el desarrollo muscular de los peces
Mientras que los programas de mejoramiento genético tienen múltiples objetivos de crianza, la tasa de crecimiento es valorada universalmente. Algunos programas tienen como meta una mayor inversión en la musculatura (filete), la proporción de los peces que es consumida.
La miostatina (mstn) es un regulador clave del crecimiento del músculo esquelético en todos los vertebrados y regula la diferenciación del mioblasto in vitro. La proteína mstn se conserva en peces teleósteos, pero se desconocía sus funciones en los peces debido a la falta de mutaciones nulas espontáneas.
La eliminación de mstn contribuyó a la comprensión de las funciones de este gen en los peces y puede aportar a la alteración intencionada del fenotipo. Los experimentos de edición del genoma se han centrado en el gen de la miostatina de varios peces cultivados.
El bagre amarillo (Pelteobagrus fulvidraco) es uno de las más importantes especies de la acuicultura en agua dulce en China. Sin embargo, su pequeño tamaño y su baja producción de filete limita su valor. Dong y su equipo silenciaron el gen mstn y reportaron el incremento de la masa muscular entre la cabeza y la aleta dorsal en los bagres de un mes de edad.
La carpa común (Cyprinus carpio) es cultivada en más de 100 países. La presencia de espinas intramusculares evita que se convierta en un popular pescado de consumo. Zhong emplearon técnica de edición del genoma para los genes vinculados con los huesos y el desarrollo muscular. Los resultados demostraron la efectividad de TALEN y CRISPR/Cas9 para modificar el genoma de la carpa.
Khalil y su equipo emplearon CRISPR/Cas9 para modificar el gen mstn del bagre del canal. Las larvas con mstn editado tuvieron más células musculares que los controles, el peso promedio del cuerpo de las larvas de bagre editados se incrementó en 29.7%.
En la brema del mar Rojo (Pagrus major), Kishimoto y sus colaboradores, empleando CRISPR/Cas9, demostraron el silenciamiento completo de mstn. Los peces mostraron un incremento de 16% en el músculo esquelético, además de un cuerpo de corta longitud.
Confinamiento reproductivo y desarrollo embrionario
Los peces de cultivo rutinariamente pueden escapar de las instalaciones acuícolas. Ellos representan importantes impactos ecológicos para los ecosistemas receptores, especialmente si son especies no nativas.
Estas preocupaciones son especialmente pertinentes donde el desarrollo de la acuacultura es intensivo y donde existen poblaciones que se quieren conservar en un ecosistema accesible. Además, el confinamiento reproductivo protege el interés de los productores en su inversión en un programa de mejoramiento genético.
Los peces exhiben una diversidad de sistemas de determinación del sexo. Aquellos sistemas no están bien caracterizados en las especies acuícolas. Las técnicas de edición del genoma han contribuido a entender la determinación del sexo en algunas especies y en el desarrollo de poblaciones confinadas.
Zhang y su equipo emplearon CRISPR/Cas9 para silenciar el gen dmrt6 en tilapia del Nilo. Esto resultó en pocos espermatocitos. Sin embargo, posteriormente la espermatogénesis gradualmente se recuperó.
Resistencia a enfermedades
Los acuicultores rutinariamente incrementan las densidades de las poblaciones en cultivo, y los organismos pueden estar sometidos a estrés fisiológico o social, volviéndolos susceptibles a los parásitos y patógenos.
Varios experimentos de edición del genoma han mejorado la resistencia a las enfermedades.
Los receptores tipo Toll (TLR) son glicoproteínas de membrana integrales con dominios de repetición rica en leucina (LRR) en sus regiones extracelulares para unirse a patrones moleculares asociados a patógenos (PAMP), y un dominio receptor de interleucina 1 Toll (TIR), que transmite señales corriente abajo en el citosol para indicar la respuesta del sistema inmunológico.
Chakrapani y sus colaboradores utilizaron el sistema CRISPR/Cas9 para interrumpir el gen receptor 22 tipo Toll (TLR22) del rohu (Labeo rohita), la principal carpa de cultivo en India.
La enfermedad hemorrágica de la carpa herbívora (Ctenopharyngodon idellus) genera grandes pérdidas a los piscicultores. Ma y su equipo de investigadores emplearon CRISPR/Cas9 para silenciar el gen JAM y evaluaron in vitro la resistencia contra varios genotipos de reovirus. Los resultados mostraron que la técnica redujo la infección en las células del riñón de la carpa herbívora.
Hacia la adopción de los peces con genoma editado
Los dos primeros productos de animales modificados genéticamente para los consumidores son los peces. GloFish, un pez ornamental fluorescente, y el salmón AquAdvantage que crece más rápido que el salmón del Atlántico, ambos peces son comercializados en Canadá y Estados Unidos.
Contexto regulatorio
Es posible que sea necesario actualizar las definiciones técnicas que subyacen a las políticas reguladoras de biotecnología existentes para incluir nuevas tecnologías de reproducción, como la edición del genoma.
SDN-1 y SDN-2 pueden introducir cambios de pares de bases o pequeñas inserciones o deleciones sin la adición de ADN extraño; el cambio exacto no puede predeterminarse y es casi aleatorio en el sitio de destino.
La distinción entre estas categorías de SDN en las políticas públicas puede afectar la supervisión gubernamental de los animales producidos por la tecnología de edición del genoma, y probablemente también la percepción pública de las aplicaciones de la edición del genoma.
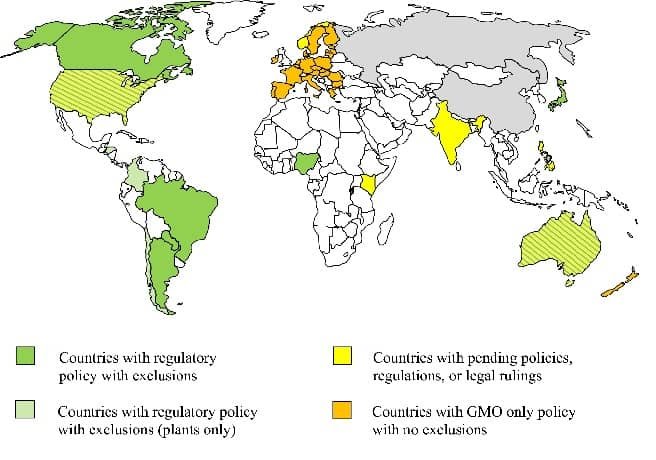
Fig. 01. Resumen de los regímenes regulatorios nacionales o supranacionales para animales genéticamente modificados o editados por genoma. Fuente: Hallerman (2021).
Contexto comercial
Tres líneas de peces con genoma editado están avanzando hacia la producción comercial.
Regional Fish Institute Ltd., con sede en Kioto, ha presentado solicitudes al Ministry of Health, Labor and Welfare y el Ministry of Agriculture, Forestry and Fisheries para comercializar peces con genoma editado.
Otro producto que viene siendo sometido a revisiones regulatorias, el FLT-01 de tilapia del Nilo, fue desarrollado por AquaBounty.
Aceptación del consumidor
La comercialización de animales (y plantas) modificados genéticamente por las técnicas clásicas de transferencia de genes fueron complicadas por la falta de aceptación del consumidor.
Si las respectivas autoridades reguladoras llegan a considerar los productos de la edición del genoma como no modificados genéticamente, entonces el público en general aceptará la garantía regulatoria de que el producto es seguro.
Es posible que la aceptación por parte del consumidor no sea una barrera importante para la comercialización de tales productos de animales con genoma editado. Sin embargo, otras aplicaciones de edición del genoma agregan secuencias de ADN o modifican las secuencias diana de formas que no podría lograrse mediante cruces dentro de las especies.
Desarrollo de infraestructura técnica
La adopción de poblaciones reproducidas selectivamente varía entre las especies acuícolas; todo el cultivo de salmón del Atlántico incluye líneas criadas selectivamente, pero virtualmente ninguna de las carpas chinas e indias, que colectivamente contribuyen con el 48% de la producción acuícola mundial, están genéticamente mejoradas.
El desarrollo de infraestructura para la reproducción selectiva y la distribución de líneas mejoradas genéticamente es el mayor desafío que enfrenta los sectores más importantes de la industria acuícola mundial.
Perspectivas
“Los estudios revisados tienen un considerable impacto en el desarrollo de conocimiento básico, particularmente para conocer el proceso de germinación celular y diferenciación y maduración gonadal” concluye el investigador.
Halleman indica que la comercialización de los productos de animales con edición del genoma como alimento será un importante desarrollo en términos de mostrar una forma para comercializar y atraer la inversión en el desarrollo de nuevas líneas de animales con genoma editado.
Referencia (acceso libre):
Hallerman, E. Genome editing in cultured fishes. CABI Agric Biosci 2, 46 (2021). https://doi.org/10.1186/s43170-021-00066-3
Editor de la revista digital AquaHoy. Biólogo Acuicultor titulado por la Universidad Nacional del Santa (UNS) y Máster en Gestión de la Ciencia y la Innovación por la Universidad Politécnica de Valencia, con diplomados en Innovación Empresarial y Gestión de la Innovación. Posee amplia experiencia en el sector acuícola y pesquero, habiendo liderado la Unidad de Innovación en Pesca del Programa Nacional de Innovación en Pesca y Acuicultura (PNIPA). Ha sido consultor senior en vigilancia tecnológica, formulador y asesor de proyectos de innovación, y docente en la UNS. Es miembro del Colegio de Biólogos del Perú y ha sido reconocido por la World Aquaculture Society (WAS) en 2016 por su aporte a la acuicultura.

