La expansión proyectada de la industria acuícola global enfrenta un obstáculo significativo: los brotes de enfermedades causadas por patógenos bacterianos. Dentro de este panorama, las infecciones por patógenos del género Flavobacterium son persistentes, especialmente en la acuicultura de salmónidos.
Tradicionalmente, el tratamiento se ha limitado al uso de antimicrobianos, una práctica que conlleva riesgos serios: contaminación del medio acuático y la promoción de la resistencia a los antimicrobianos (RAM). La acuicultura se ha catalogado como un «punto caliente» para la evolución de genes de resistencia a los antibióticos.
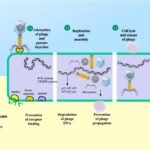
Frente a esta situación, la investigación se ha volcado hacia alternativas más sostenibles y responsables. Es aquí donde surgen los bacteriófagos (o fagos), virus que atacan y eliminan bacterias de forma natural, ofreciendo una vía prometedora para la prevención y el control de enfermedades.
Este artículo, publicado por investigadores de la University of Copenhagen, de la University of Jyväskylä, de la Technical University of Denmark y de la University of Southern Denmark, desglosa el potencial de la fagoterapia en acuicultura como herramienta para combatir patógenos clave de Flavobacterium como F. columnare y F. psychrophilum.
Conclusiones clave
- La resistencia a los fagos en patógenos de Flavobacterium (F. columnare y F. psychrophilum) se asocia frecuentemente con mutaciones en el Sistema de Secreción Tipo IX (T9SS). Esta resistencia conlleva una pérdida o reducción de la virulencia del patógeno, lo que convierte a los fagos en una vía prometedora para el control de patógenos.
- Los fagos que infectan a Flavobacterium demuestran ser persistentes a las condiciones ambientales y de almacenamiento, manteniéndose activos durante años a 4 oC en formulaciones líquidas y reteniendo infectividad en piensos secos almacenados a 5 oC hasta por 8 meses. Esto los hace potencialmente aptos para el desarrollo de productos comerciales.
- Existe evidencia experimental de que la fagoterapia puede controlar eficazmente al patógeno a escala de laboratorio. El impacto más eficiente se logra al administrar los fagos al agua como tratamiento de baño cuando aparecen los primeros síntomas, lo que conduce a una reducción eficiente de la población bacteriana virulenta.
- A pesar del potencial, persisten importantes desafíos que limitan el desarrollo de productos comerciales viables. Estos incluyen la necesidad de realizar pruebas a escala de granja, resolver la complejidad regulatoria, optimizar los métodos de producción y entrega a escala industrial, y abordar el riesgo de resistencia adaptativa (como CRISPR-Cas en F. columnare).
- La fagoterapia ofrece un enfoque ambientalmente responsable que no promueve la resistencia a los antimicrobianos, posicionándose como una alternativa urgente y necesaria a los tratamientos con antibióticos, que contaminan el medio acuático y promueven la resistencia.
Cómo funcionan los fagos: un arma natural
Los fagos se han investigado por su capacidad para prevenir y controlar enfermedades y la formación de biopelículas (biofilms) en acuicultura. Los fagos que infectan a Flavobacterium ya han demostrado ser persistentes a las condiciones ambientales y de almacenamiento, lo que los hace adecuados para el desarrollo de productos comerciales.
La conexión entre fagos, T9SS y pérdida de virulencia
Un hallazgo crucial en la interacción fago-huésped es la relación entre la resistencia a los fagos y la pérdida de virulencia del patógeno.
- Mecanismo de resistencia: Los fagos se unen a receptores específicos en la superficie de la célula bacteriana, como proteínas de la membrana externa o glicoconjugados de superficie. Para evadir la infección, las bacterias pueden mutar estos receptores.
- El Rol del T9SS: Estas mutaciones a menudo afectan genes asociados al Sistema de Secreción Tipo IX (T9SS). Este complejo sistema es vital para la movilidad de deslizamiento (gliding motility) y la secreción de enzimas y adhesinas.
- El Trade-off: El T9SS también juega un papel esencial en la virulencia de F. columnare y F. psychrophilum. Cuando una bacteria muta los componentes del T9SS para volverse resistente al fago, esta alteración tiene un costo biológico: se interrumpe la maquinaria de deslizamiento, se afecta la secreción de proteasas y se producen cambios en la formación de biopelículas.
- Implicación práctica: Aislamientos resistentes a fagos han mostrado una capacidad reducida o nula para causar mortalidad en truchas arcoíris y peces cebra infectados experimentalmente. Esto sugiere que, incluso si el patógeno desarrolla resistencia, el objetivo de control de la enfermedad se logra al transformarse en una cepa inofensiva o atenuada.
Diversidad y alcance de los fagos de Flavobacterium
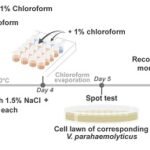
El estudio reporta que se han aislado y publicado más de 280 fagos que infectan a F. columnare y F. psychrophilum. La gama de huéspedes (host range) es una consideración clave para la fagoterapia, ya que los fagos deben ser capaces de infectar la diversidad de cepas presentes en una granja.
- Alto éxito de infección: Las colecciones de fagos han logrado infectar a un alto porcentaje de aislados de patógenos: hasta un 98% de aislados de F. psychrophilum a nivel global y un 94% de aislados de F. columnare.
- Adaptación evolutiva: La coevolución antagónica entre fagos y bacterias es uno de los procesos evolutivos más rápidos. Estudios en acuicultura han demostrado que las bacterias desarrollan resistencia a los fagos de años pasados, pero son menos resistentes a los fagos más recientes. Esto subraya la necesidad de un aislamiento constante y el uso de la técnica de «entrenamiento de fagos» (phage training) para ampliar su rango de huésped frente a cepas resistentes.
El desafío de la resistencia CRISPR-Cas
Los fagos son la contramedida natural a las bacterias, pero estas también tienen sus defensas. Además de las mutaciones superficiales, las bacterias poseen sistemas de inmunidad adaptativa como CRISPR-Cas.
- En F. columnare: Esta especie tiene dos loci CRISPR activos (subtipos II-C y VI-B) que adquieren «memoria» (espaciadores) en respuesta a la exposición a fagos, lo que confirma su participación activa en la defensa contra fagos en poblaciones naturales.
- En F. psychrophilum: Aunque se han identificado sistemas CRISPR, la estabilidad de su composición de espaciadores sugiere que no es un mecanismo de defensa dinámico y activo en la misma medida que las mutaciones de superficie.
En este contexto, la estrategia de control biológico parece más prometedora en F. psychrophilum, donde la resistencia suele ser exclusivamente por modificación de la superficie (resultando en pérdida de virulencia). En cambio, la capacidad de F. columnare para utilizar sistemas CRISPR adaptativos podría dificultar el mantenimiento a largo plazo de una estrategia de control basada en fagos sin ajustes.
Mantente siempre informado
Únete a nuestras comunidades para recibir al instante las noticias, informes y análisis más importantes del sector acuícola.
Métodos de entrega y estabilidad: llevando los fagos al pez
El éxito de la fagoterapia depende de un método de entrega eficaz, que debe adaptarse a la vía de infección del patógeno.
Métodos probados:
- Tratamientos por baño: Es la estrategia más adecuada para patógenos que colonizan superficies externas como las branquias (F. branchiophilum, F. columnare). Los tratamientos por baño han demostrado un control prometedor de la colonización bacteriana y la mortalidad.
- Administración oral (Pienso): Para F. psychrophilum, que causa infección sistémica, el pienso infundido con fagos ha logrado entregar fagos infectivos al intestino y el bazo. Sin embargo, la efectividad es limitada, posiblemente por la concentración insuficiente en el pienso o la inactivación en el estómago ácido de la trucha arcoíris (pH promedio de 4.9 durante la alimentación).
- Biofiltros y Biofilms: Los fagos de F. columnare se agrupan preferentemente en biopelículas unidas a los medios de biofiltro en los Sistemas de Acuicultura de Recirculación (RAS), actuando como reservorios y manteniendo la efectividad por al menos 21 días. Esto sugiere que la inmovilización de fagos en biomateriales (como biofiltros) podría ser una estrategia de prevención viable para reducir la carga de patógenos en el sistema.
Estabilidad:
Los fagos que atacan a Flavobacterium son estables en condiciones de pH neutro (7.0-7.5) y tienen una notable tolerancia a la temperatura y la desecación.Los lisados purificados pueden permanecer activos durante varios años a 4 oC. Los fagos en pienso han mantenido entre un 10% y un 60% de infectividad después de 8 meses de almacenamiento a 5 oC y -80 oC, respectivamente.
Retos pendientes: de la investigación al mercado
A pesar del potencial, la fagoterapia en acuicultura aún enfrenta retos clave para su comercialización:
- Regulación: En EE.UU. y la UE, los productos de fagos se regulan según su uso previsto (tratamiento de enfermedades, aditivo alimentario, bioplaguicida), lo que crea un panorama complejo. Los productos destinados a la descontaminación o como aditivos alimentarios tienen requisitos regulatorios más sencillos que los medicamentos veterinarios.
- Producción a escala: Los protocolos actuales se limitan a la producción a escala de laboratorio. La producción industrial debe cumplir con estándares de Buenas Prácticas de Fabricación (GMP) que aún no se han desarrollado para los fagos de Flavobacterium.
- Seguridad y pureza: La producción implica el uso de bacterias patógenas, lo que podría suponer un riesgo de transferencia horizontal de genes de virulencia. Además, la lisis bacteriana libera metabolitos y endotoxinas que pueden ser nocivos para los peces (se ha observado mortalidad en truchas arcoíris expuestas a lisados crudos). Es necesario adaptar protocolos de purificación a escala industrial.
- Pruebas en condiciones de granja: La validación debe pasar de los modelos de desafío con cepas específicas a las pruebas a escala de granja que simulen brotes naturales y aborden la diversidad natural de patógenos.
Conclusión
La investigación sobre la interacción fago-Flavobacterium ha revelado un potencial considerable para la fagoterapia. El mecanismo de resistencia que resulta en la pérdida de virulencia es un punto fuerte único que sugiere que la fagoterapia puede controlar la enfermedad, independientemente de la resistencia bacteriana.
Para que este potencial se traduzca en una solución comercialmente viable y sostenible, es imprescindible abordar los desafíos de regulación, la optimización de la producción a gran escala y el desarrollo de protocolos de calidad. La fagoterapia representa una herramienta esencial para la resiliencia y el crecimiento responsable de la acuicultura.
Contacto
Mathias Middelboe
Marine Biology Section, Department of Biology, University of Copenhagen
Helsingør, Denmark
Department of Biology, University of Southern Denmark
Odense, Denmark
Email: mmiddelboe@bio.ku.dk
Referencia (acceso abierto)
L. A. I. Landor, V. Ruffo, L.-R. Sundberg, L. Madsen, and M. Middelboe, “Phage-Host Interactions in Flavobacterium Pathogens and the Potential of Phage-Based Disease Control in Salmonid Aquaculture,” Reviews in Aquaculture 18, no. 1 (2026): e70115, https://doi.org/10.1111/raq.70115.
Editor de la revista digital AquaHoy. Biólogo Acuicultor titulado por la Universidad Nacional del Santa (UNS) y Máster en Gestión de la Ciencia y la Innovación por la Universidad Politécnica de Valencia, con diplomados en Innovación Empresarial y Gestión de la Innovación. Posee amplia experiencia en el sector acuícola y pesquero, habiendo liderado la Unidad de Innovación en Pesca del Programa Nacional de Innovación en Pesca y Acuicultura (PNIPA). Ha sido consultor senior en vigilancia tecnológica, formulador y asesor de proyectos de innovación, y docente en la UNS. Es miembro del Colegio de Biólogos del Perú y ha sido reconocido por la World Aquaculture Society (WAS) en 2016 por su aporte a la acuicultura.