El uso excesivo de antibióticos en la industria de la acuicultura ha derivado en la aparición de resistencias, un riesgo para la salud pública y el medio ambiente. En este escenario, la terapia con bacteriófagos (fagos) —virus que infectan y destruyen bacterias específicas— emerge como una alternativa prometedora y ecológica.
Sin embargo, la eficacia de la fagoterapia no está garantizada. Las bacterias han desarrollado un sofisticado arsenal de mecanismos de defensa para protegerse de los ataques de los fagos. Comprender este «blindaje» es fundamental para diseñar tratamientos efectivos. Un reciente estudio de revisión publicado en Aquaculture por investigadores de la Tezpur University, de la Koneru Lakshmaiah Education Foundation y de la Rabindranath Tagore University ha mapeado en profundidad el panorama de estos sistemas de defensa en los patógenos bacterianos más relevantes para la piscicultura, ofreciendo una guía clave para el futuro de la sanidad acuícola.
- 1 Conclusiones clave
- 2 La promesa y el desafío de la fagoterapia en acuicultura
- 3 Un arsenal genómico: más de 1,100 sistemas de defensa identificados
- 4 Los mecanismos de defensa más comunes en patógenos de peces
- 5 Estrategias defensivas varían entre los principales patógenos
- 6 Implicaciones para una fagoterapia más inteligente y robusta
- 7 Entradas relacionadas:
Conclusiones clave
- Se identificaron 1,174 sistemas de defensa antifagos en los genomas de 272 cepas bacterianas, abarcando 35 especies patógenas para peces de importancia en la acuicultura.
- Los sistemas «clásicos» como los de restricción-modificación (R-M) y CRISPR-Cas son comunes, pero también existe una gran diversidad de mecanismos emergentes con distribuciones específicas para cada linaje bacteriano.
- Las defensas a menudo se agrupan en «islas genómicas», lo que sugiere que se adquieren de forma modular y pueden transferirse horizontalmente entre diferentes bacterias, facilitando una rápida adaptación.
- Patógenos como Vibrio y Aeromonas dependen más de sistemas innatos (R-M, infección abortiva), mientras que Flavobacterium utiliza activamente la inmunidad adaptativa CRISPR-Cas, mostrando una coevolución directa con los fagos en entornos de cultivo.
- Conocer el repertorio de defensas de un patógeno es crucial para diseñar terapias con fagos más efectivas, como la rotación de cócteles o el uso de fagos modificados para superar estas barreras.
La promesa y el desafío de la fagoterapia en acuicultura
La terapia con fagos funciona aprovechando la acción lítica de estos virus para eliminar bacterias patógenas de forma muy específica, sin afectar a la microbiota beneficiosa del entorno. Desde su primer éxito reportado en 1981 contra Aeromonas hydrophila, numerosos estudios de laboratorio han demostrado su potencial para reducir la carga patógena y mejorar las tasas de supervivencia en peces.
No obstante, la transición del laboratorio a las condiciones reales de una granja acuícola presenta desafíos significativos. Factores como la temperatura, el pH, la salinidad y la carga orgánica pueden afectar la estabilidad y eficacia de los fagos. Además, las bacterias pueden desarrollar resistencia, lo que exige estrategias más complejas como el uso de «cócteles de fagos» que atacan al patógeno desde múltiples frentes. El principal obstáculo, sin embargo, reside en el propio genoma bacteriano: un vasto repertorio de sistemas de defensa listos para activarse.
Un arsenal genómico: más de 1,100 sistemas de defensa identificados
Para entender la magnitud de este arsenal, los investigadores analizaron 272 genomas de alta calidad, representando a 35 especies de bacterias patógenas de peces. Utilizando herramientas bioinformáticas, identificaron un total de 1,174 sistemas de defensa antifagos, clasificados en 304 tipos distintos.
Estos sistemas no se distribuyen al azar. Frecuentemente se encuentran agrupados en regiones específicas del genoma conocidas como «islas de defensa». Esta organización sugiere que los sistemas pueden ser adquiridos y transferidos entre bacterias a través de la transferencia horizontal de genes, permitiendo una adaptación rápida a la presión de los fagos en el ambiente acuático.
Los mecanismos de defensa más comunes en patógenos de peces
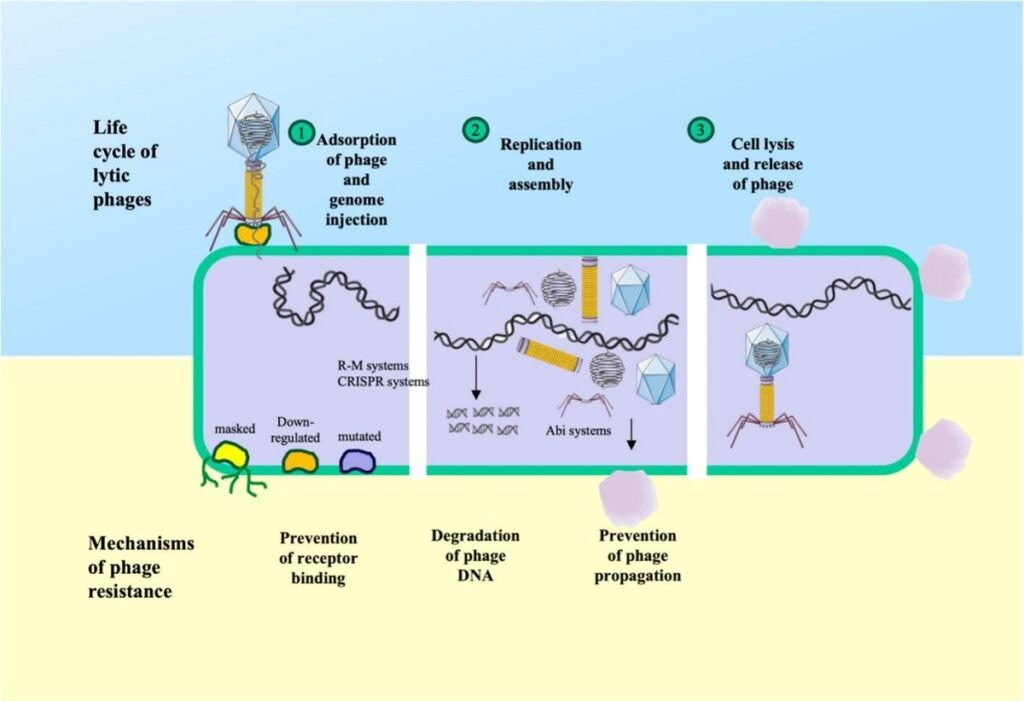
Aunque la diversidad es enorme, la mayoría de las defensas se pueden agrupar en varias estrategias principales que las bacterias emplean para sobrevivir a una infección por fagos.
Sistemas de restricción-modificación (R-M): la primera línea de defensa
Este es uno de los sistemas más extendidos. Funciona como un sistema de discriminación «propio/extraño». Una enzima (metiltransferasa) marca el ADN de la propia bacteria con una etiqueta química (metilación). Cuando un fago inyecta su ADN, otra enzima (endonucleasa de restricción) lo inspecciona. Si el ADN del fago no tiene la marca correcta, es identificado como extraño y destruido. Se han encontrado sistemas R-M en patógenos clave como Aeromonas hydrophila, Vibrio anguillarum y Piscirickettsia salmonis.
CRISPR-Cas: la memoria inmunológica adaptativa
El sistema CRISPR-Cas es más sofisticado, ya que proporciona una inmunidad adaptativa y heredable. Cuando un fago ataca por primera vez, la bacteria puede capturar un pequeño fragmento del ADN del fago y almacenarlo en una región de su propio genoma llamada locus CRISPR. Si el mismo fago (o uno similar) vuelve a atacar, la bacteria utiliza ese fragmento almacenado como guía para reconocer y destruir el material genético del invasor de manera muy precisa. Este mecanismo es especialmente prevalente y activo en especies como Flavobacterium columnare, donde se ha observado una coevolución constante entre las defensas CRISPR de la bacteria y las mutaciones de los fagos en granjas piscícolas.
Mantente siempre informado
Únete a nuestras comunidades para recibir al instante las noticias, informes y análisis más importantes del sector acuícola.
Infección abortiva (Abi): el sacrificio por el bien común
Si los sistemas anteriores fallan, algunas bacterias recurren a una estrategia de «suicidio celular» o altruismo. Los sistemas de infección abortiva (Abi) se activan tras la infección y detienen el metabolismo de la célula o la destruyen antes de que el fago pueda completar su ciclo de replicación y producir nuevas partículas virales. Aunque la célula infectada muere, este sacrificio evita la propagación del fago y protege al resto de la población bacteriana. Se han identificado sistemas Abi en patógenos como Aeromonas salmonicida y Flavobacterium spp..
Estrategias defensivas varían entre los principales patógenos
El estudio revela que no todos los patógenos dependen de las mismas defensas.
- Vibrio y Aeromonas: Estos géneros, responsables de enfermedades como la vibriosis y la septicemia hemorrágica, muestran una baja prevalencia de sistemas CRISPR-Cas. En su lugar, confían principalmente en sistemas R-M, defensas de superficie (como la modificación de receptores) y sistemas de infección abortiva.
- Flavobacterium: A diferencia de los anteriores, patógenos como F. columnare y F. psychrophilum utilizan activamente los sistemas CRISPR-Cas como una defensa dinámica, adquiriendo nuevas secuencias de fagos para adaptarse a las amenazas locales.
- Piscirickettsia salmonis: Este patógeno intracelular, causante de la septicemia rickettsial salmonídea, presenta un repertorio de defensa multicapa muy complejo. Un análisis genómico reveló sistemas para agotar los componentes básicos del ADN del fago (dGTPasa), sistemas de infección abortiva (AbiD) y múltiples sistemas de toxina-antitoxina, muchos de ellos localizados en plásmidos, lo que facilita su diseminación.
Implicaciones para una fagoterapia más inteligente y robusta
La conclusión principal de esta exhaustiva revisión es clara: para que la fagoterapia sea una herramienta fiable y duradera en acuicultura, es indispensable conocer al enemigo y sus defensas. Ignorar el «blindaje» bacteriano puede llevar al fracaso del tratamiento.
El estudio propone una hoja de ruta pragmática:
- Perfilar las defensas: Antes de aplicar un tratamiento, analizar el repertorio de defensas del patógeno objetivo.
- Diseñar cócteles estratégicos: Utilizar combinaciones de fagos que las bacterias no puedan contrarrestar fácilmente o rotar los cócteles para evitar la aparición de resistencias generalizadas.
- Desarrollar fagos «mejorados»: La ingeniería genética permite crear fagos capaces de evadir defensas específicas, por ejemplo, produciendo proteínas que inactivan los sistemas CRISPR bacterianos (anti-CRISPRs).
Con un enfoque más racional y basado en la evidencia, la fagoterapia puede pasar de ser una promesa a convertirse en una modalidad robusta y alineada con la gestión sostenible, reduciendo la dependencia de los antibióticos y fortaleciendo la resiliencia a largo plazo de la acuicultura mundial.
Contacto
Aditya Kumar
Department of Molecular Biology and Biotechnology, Tezpur University, Tezpur 784028, Assam, India
Email: aditya@tezu.ernet.in
Referencia
Olymon, K., Kinoo, N., Roy, N., Yella, V. R., Teronpi, V., & Kumar, A. (2025). Fish pathogen armor: A review of antiphage defense systems in bacterial fish pathogens. Aquaculture, 743192. https://doi.org/10.1016/j.aquaculture.2025.743192
Editor de la revista digital AquaHoy. Biólogo Acuicultor titulado por la Universidad Nacional del Santa (UNS) y Máster en Gestión de la Ciencia y la Innovación por la Universidad Politécnica de Valencia, con diplomados en Innovación Empresarial y Gestión de la Innovación. Posee amplia experiencia en el sector acuícola y pesquero, habiendo liderado la Unidad de Innovación en Pesca del Programa Nacional de Innovación en Pesca y Acuicultura (PNIPA). Ha sido consultor senior en vigilancia tecnológica, formulador y asesor de proyectos de innovación, y docente en la UNS. Es miembro del Colegio de Biólogos del Perú y ha sido reconocido por la World Aquaculture Society (WAS) en 2016 por su aporte a la acuicultura.