La acuacultura de camarones, un pilar económico global, vive bajo la amenaza constante de enfermedades virales que pueden arrasar con producciones enteras en cuestión de días. El virus del síndrome de la mancha blanca (WSSV) es, sin duda, el patógeno más temido, capaz de causar mortalidades de hasta el 100%. Ante este desafío, la ciencia busca soluciones más allá de los métodos tradicionales. Una de las tecnologías más prometedoras es la Interferencia de ARN (RNAi), una estrategia de silenciamiento génico que funciona como un «interruptor» molecular capaz de apagar genes específicos de los virus, impidiendo su replicación.
Sin embargo, el gran reto no es solo diseñar la molécula de RNAi correcta, sino llevarla hasta el lugar indicado dentro del camarón de una forma práctica y económica. Un reciente artículo de revisión publicado en Fish and Shellfish Immunology por científicos de la Mindanao State University y de la University of Santo Tomas explora a fondo los avances en los sistemas de entrega de RNAi, comparando desde bacterias y algas hasta nanopartículas, y delineando el camino a seguir para que esta tecnología pase del laboratorio a los estanques.
- 1 Conclusiones clave
- 2 ¿Qué es el silenciamiento génico o RNAi?
- 3 El desafío no es el qué, sino el cómo: la entrega del RNAi
- 4 Vehículos de entrega: ¿Quién lleva el mensaje del RNAi?
- 5 ¿Del laboratorio al estanque? los retos para una aplicación real
- 6 Conclusión: un futuro prometedor pero que requiere más investigación
- 7 Entradas relacionadas:
Conclusiones clave
- La tecnología de Interferencia de ARN (RNAi) es una herramienta prometedora y altamente específica para silenciar genes virales clave (como los del WSSV) o genes del camarón que los virus necesitan para replicarse.
- Aunque la inyección de moléculas de ARN de doble cadena (dsRNA) es efectiva en laboratorio, es inviable a escala comercial. El futuro del RNAi en la camaronicultura depende de sistemas de entrega orales y eficientes.
- Los sistemas de entrega biológicos, como bacterias (probióticos), microalgas y levaduras modificadas para producir dsRNA, ofrecen una ruta escalable y más segura para la administración a través del alimento.
- Las nanopartículas sintéticas (como VLPs y complejos de quitosano) demuestran la mayor eficacia de protección y estabilidad del dsRNA, pero su costo y escalabilidad aún son un desafío para el campo.
¿Qué es el silenciamiento génico o RNAi?
El RNAi es un mecanismo de defensa natural que tienen los organismos eucariotas, incluidos los camarones, para protegerse de los virus que utilizan ARN de doble cadena (dsRNA) en su ciclo de vida. La tecnología aprovecha este proceso. Al introducir en el camarón una molécula de dsRNA diseñada para que su secuencia coincida con la de un gen vital del virus (por ejemplo, el gen vp28 del WSSV), se activa una maquinaria celular que busca y destruye el ARN mensajero (ARNm) viral correspondiente. Sin ese ARNm, el virus no puede producir sus proteínas esenciales y, en consecuencia, no puede replicarse, deteniendo la infección en seco.
Existen varias moléculas que pueden iniciar este proceso:
- dsRNA (ARN de doble cadena): Moléculas largas que son procesadas por la célula en fragmentos más pequeños.
- siRNA (ARN pequeño de interferencia): Fragmentos cortos y específicos que se cargan directamente en el complejo de silenciamiento.
- shRNA y lhRNA (ARN en horquilla corto y largo): Moléculas que se expresan dentro de las células a partir de un vector (como un plásmido en una bacteria) y luego se procesan para volverse activas.
El desafío no es el qué, sino el cómo: la entrega del RNAi
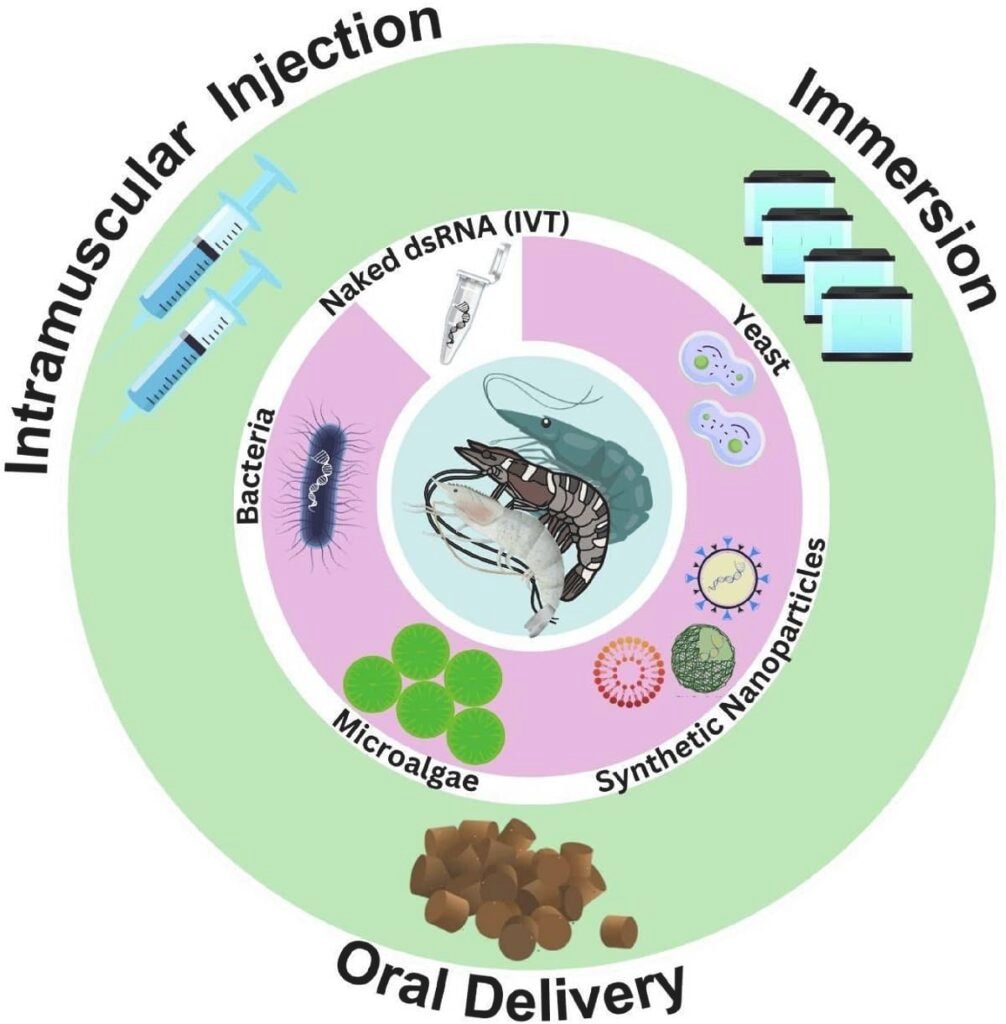
Los primeros estudios demostraron la eficacia del RNAi inyectando directamente el dsRNA en los camarones. Si bien esto funciona en un entorno de laboratorio controlado, es absolutamente impráctico y costoso para las miles o millones de larvas y juveniles en una granja comercial. Por ello, la investigación se ha centrado en desarrollar métodos de administración masiva, principalmente a través de la vía oral, incorporando el RNAi en el alimento.
Para que la administración oral funcione, el dsRNA necesita un «vehículo» que lo proteja de la degradación en el agua y en el tracto digestivo del camarón, y que facilite su absorción. Aquí es donde la innovación está marcando la diferencia.
Vehículos de entrega: ¿Quién lleva el mensaje del RNAi?
El estudio revisa exhaustivamente cuatro plataformas principales para la producción y entrega oral de dsRNA, cada una con sus propias ventajas y desventajas.
Bacterias: fábricas vivas de dsRNA
El uso de bacterias genéticamente modificadas es uno de los métodos más costo-efectivos y escalables. Se utilizan cepas de Escherichia coli (como la HT115, deficiente en RNasas) o probióticos como Bacillus subtilis y Lactobacillus plantarum para producir grandes cantidades de dsRNA específico contra un virus. Estas bacterias, a menudo inactivadas, pueden ser incorporadas directamente en el alimento.
- Ventajas: Bajo costo de producción y alta escalabilidad. Los probióticos, además, aportan beneficios a la salud intestinal del camarón.
- Desventajas: La estabilidad del dsRNA una vez ingerido puede ser limitada. Además, el uso de E. coli modificado genéticamente enfrenta barreras regulatorias y de percepción pública.
Microalgas: un vehículo nutritivo y seguro
Las microalgas, como Chlamydomonas reinhardtii, son una alternativa muy atractiva. Son un componente natural de la dieta de los camarones, ricos en nutrientes y considerados seguros (estatus GRAS). Se pueden modificar genéticamente para que produzcan dsRNA en sus cloroplastos. El camarón ingiere la biomasa de alga completa, que actúa como una cápsula natural.
Mantente siempre informado
Únete a nuestras comunidades para recibir al instante las noticias, informes y análisis más importantes del sector acuícola.
- Ventajas: Son seguras, nutritivas y no generan el mismo rechazo regulatorio que las bacterias.
- Desventajas: La pared celular de algunas algas puede ser difícil de digerir, lo que podría limitar la liberación y la eficiencia del dsRNA en el intestino del camarón.
Levaduras: otra opción biosegura
Al igual que las microalgas, las levaduras como Yarrowia lipolytica son una plataforma segura (GRAS) y se han utilizado como inmunoestimulantes en acuicultura. Se ha demostrado que pueden ser bioingenierizadas para producir dsRNA contra el WSSV y reducir la expresión de genes virales en camarones alimentados con ellas.
- Ventajas: Estatus GRAS y mínimo riesgo ambiental.
- Desventajas: La protección reportada hasta ahora ha sido moderada (~25% de reducción en la expresión génica viral), y la estrategia aún necesita optimización.
Nanopartículas sintéticas: la alta tecnología al rescate
Este es el campo más avanzado y el que ofrece la mayor protección. Consiste en encapsular el dsRNA en partículas nanométricas que lo protegen de la degradación y mejoran su absorción celular.
- Partículas similares a virus (VLPs): Son cápsides de virus vacías, no infecciosas, que pueden rellenarse con dsRNA. Al imitar a un virus real, engañan a las células del camarón para que las internalicen, logrando una entrega muy eficiente. Se ha reportado hasta un 100% de supervivencia en camarones desafiados con WSSV tras la inyección de VLPs cargadas con dsRNA.
- Nanopartículas poliméricas y lipídicas: Materiales como el quitosano (un derivado de los caparazones de crustáceos) o los liposomas pueden formar complejos con el dsRNA, protegiéndolo y facilitando su entrada a las células. Los estudios muestran tasas de supervivencia de hasta el 80-95%.
- Ventajas: Máxima estabilidad del dsRNA y eficiencia de entrega muy alta.
- Desventajas: El costo de producción es significativamente más alto y su aplicación a gran escala en el alimento es más compleja y cara que las opciones biológicas.
¿Del laboratorio al estanque? los retos para una aplicación real
A pesar de los avances, la transición del RNAi a una herramienta comercial enfrenta tres grandes obstáculos:
- Costo de producción: Aunque ha bajado drásticamente (de >300 USD/mg con métodos de laboratorio a <50 USD/mg con sistemas bacterianos), sigue siendo un factor limitante para su uso masivo.
- Estabilidad en el campo: El dsRNA es una molécula frágil que se degrada rápidamente en el agua de los estanques por la acción de microbios, enzimas y luz UV. Un vehículo de entrega eficaz debe garantizar su estabilidad no solo durante la fabricación del alimento, sino también en el ambiente acuático.
- Estandarización de la dosis: Es muy difícil saber cuánto dsRNA consume realmente cada camarón en un estanque. Optimizar la dosis oral para asegurar un efecto protector sostenido en condiciones de campo variables (temperatura, salinidad, etc.) es un desafío crucial.
Conclusión: un futuro prometedor pero que requiere más investigación
La tecnología RNAi tiene el potencial de transformar la gestión sanitaria en la camaronicultura, ofreciendo una defensa específica y potente contra las enfermedades virales más devastadoras. La investigación ha demostrado que el «qué» (el silenciamiento génico) funciona. Ahora, el enfoque está en perfeccionar el «cómo» (la entrega).
Los sistemas de entrega oral, especialmente los basados en plataformas bioseguras como probióticos, microalgas y levaduras, parecen ser el camino más viable y sostenible para la aplicación a gran escala. Las nanopartículas, aunque más caras, representan el «estándar de oro» en eficacia y podrían ser clave para aplicaciones de alto valor, como en reproductores o durante fases críticas de la producción. El siguiente paso ineludible es llevar estas tecnologías a ensayos de campo bajo condiciones reales y desarrollar un marco regulatorio claro que garantice su seguridad y sostenibilidad ambiental para su adopción generalizada.
El estudio fue financiado por el Department of Science and Technology – Philippine Council for Agriculture, Aquatic and Natural Resources Research and Development (DOST-PCAARRD) bajo el proyecto titulado “Targeting Essential Genes Utilizing RNA Interference to Mitigate WSSV in Backspace Tiger Shrimp”.
Contacto
Mary Beth B. Maningas
Research Center for Natural and Applied Sciences, University of Santo Tomas
Manila, Philippines.
Email: mbmaningas@ust.edu.ph
Referencia
Pedrosa-Gerasmio, I. R., Saquilayan, K. M. D., Glori, P. J. V., Almazan, D. J. D. N., Solitario, J. T. A., & Maningas, M. B. B. (2025). A comparative review of RNAi delivery systems for shrimp aquaculture and future directions. Fish & Shellfish Immunology, 167, 110877. https://doi.org/10.1016/j.fsi.2025.110877
Editor de la revista digital AquaHoy. Biólogo Acuicultor titulado por la Universidad Nacional del Santa (UNS) y Máster en Gestión de la Ciencia y la Innovación por la Universidad Politécnica de Valencia, con diplomados en Innovación Empresarial y Gestión de la Innovación. Posee amplia experiencia en el sector acuícola y pesquero, habiendo liderado la Unidad de Innovación en Pesca del Programa Nacional de Innovación en Pesca y Acuicultura (PNIPA). Ha sido consultor senior en vigilancia tecnológica, formulador y asesor de proyectos de innovación, y docente en la UNS. Es miembro del Colegio de Biólogos del Perú y ha sido reconocido por la World Aquaculture Society (WAS) en 2016 por su aporte a la acuicultura.